
科目: 来源:不详 题型:单选题
| A.pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1 |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液因生成的CH3COONa水解,pH>7 |
| C.pH=3的HA酸溶液中c(H+)=10-3 mol·L-1,稀释为原体积的10倍后pH≤4 |
| D.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO |
| B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能为Be(OH)2 |
| C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D.BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:实验题
| A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) |
| B.c(OH-)=c(HSO4-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c(Na+)=2c(SO42-)+2c(HSO4-) |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验 编号 | HA物质的量 浓度(mol· L-1) | NaOH物质的 量浓度(mol· L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
| A.前者大 | B.后者大 |
| C.二者相等 | D.无法判断 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.常温下PH=2的甲酸与pH=12的烧碱溶液等体积混合: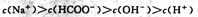 |
B.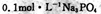 溶液中: 溶液中: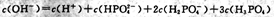 |
C.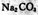 溶液加水稀释后,恢复至原温度,所有离子浓度均减小 溶液加水稀释后,恢复至原温度,所有离子浓度均减小 |
| D. 1L 0.3mol ?L-1NaOH溶液吸收标准状况下4. 48L CO2: |
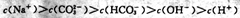
查看答案和解析>>
科目: 来源:不详 题型:单选题
 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L CH3COOH溶液所得滴定曲线如右图。下列说法正确的是
CH3COOH溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: |
| D.滴定过程中可能出现: |

查看答案和解析>>
科目: 来源:不详 题型:填空题
 ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L
 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号) 的大小关系是② ③(填“>”、“<”或“=”)
的大小关系是② ③(填“>”、“<”或“=”) 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。 ,则说明
,则说明 的水解程度 (填“>”、“<”或“=”)
的水解程度 (填“>”、“<”或“=”) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4- |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com