
科目: 来源:不详 题型:单选题
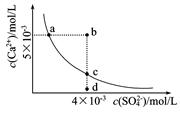
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
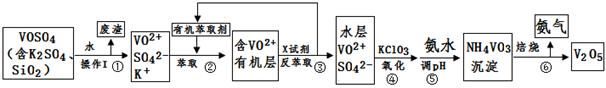
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层) | pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
 SO2 +2Cu。
SO2 +2Cu。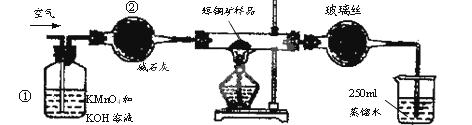
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
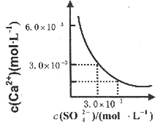
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
查看答案和解析>>
科目: 来源:不详 题型:问答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
 CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。查看答案和解析>>
科目: 来源:不详 题型:填空题


 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com