
科目: 来源:不详 题型:单选题
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小 |
| B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量的NH4Cl固体,c(Mg2+)降低 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:填空题
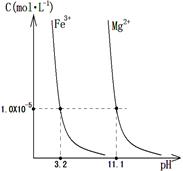
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.该实验可以证明AgI比AgCl更难溶 |
| B.加入V2 mL AgNO3溶液后,溶液中不含I- |
| C.V1= V2-V1 |
| D.向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| C.上述现象说明ZnS的Ksp小于CuS的Ksp |
| D.该过程破坏了ZnS的溶解平衡 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.AgCl不溶于水,不能转化为AgI |
| B.在含浓度均为0.001mol?L—1的Cl—、I—的溶液中缓慢滴AgNO3稀溶液,先析出AgI |
| C.AgI比AgCl更难溶于水,所以AgCl可转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于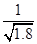 ×10—11mol?L—1 ×10—11mol?L—1 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.常温下在水中溶解能力AgCl>AgBr>AgI |
| B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C.在AgBr饱和溶液中加入NaCl固体不可能有AgCl沉淀生成 |
| D.在AgI饱和液中加入NaI固体有AgI沉淀析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com