
科目: 来源:不详 题型:单选题
A.水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),Na2CO3第一步水解反应的水解常数的表示式 Kh≤ |
B.HS-电离的离子方程式:HS-+H2O H3O++S2- H3O++S2- |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 |
| D.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为: |
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.3 | B.4 | C.5 | D.6 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.该过程吸收的热量为86.7 kJ |
| B.此过程中需要标准状况下CH4气体1.12 L |
| C.转移的电子数为0.8NA |
| D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
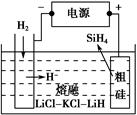
 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。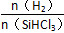 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。
查看答案和解析>>
科目: 来源:不详 题型:填空题
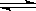 CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
CH3OH(g) ΔH1=-90.7 kJ·mol-1 ① CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 ② CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 ③ CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。
CH3OCH3(g)+CO2(g),则该反应的ΔH=__________,平衡常数表达式为____________________,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会________(填升高、降低或不变)。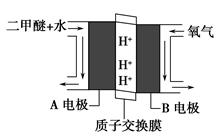
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.对于反应2SO2(g)+O2(g) 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
| B.电解法精炼铜时,精铜作阳极,粗铜作阴极 |
| C.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
D.CH3COOH溶液加水稀释后,电离程度增大,溶液中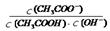 的值不变 的值不变 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
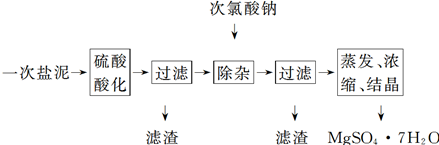
查看答案和解析>>
科目: 来源:不详 题型:单选题
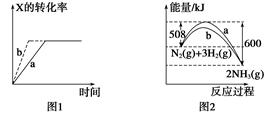
A.图1所示,反应:X(g)+2Y(g)  3Z(g),b的压强一定比a大 3Z(g),b的压强一定比a大 |
| B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 |
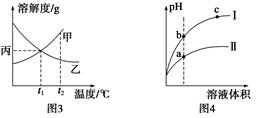
| C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
| D.图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3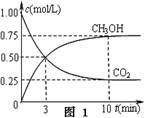
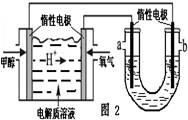
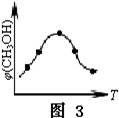
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
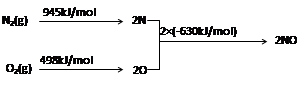
 2NO(g) △H= 。
2NO(g) △H= 。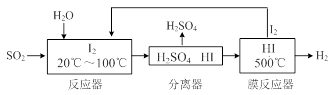
 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com