
科目: 来源:不详 题型:填空题
 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。 N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。查看答案和解析>>
科目: 来源:不详 题型:单选题
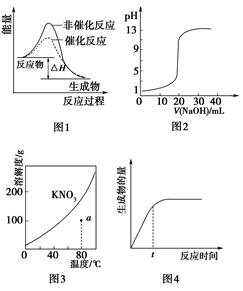
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时刻反应物转化率最大 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g) ΔH
CH3OH(g) ΔH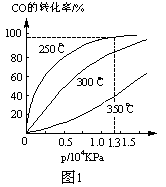
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 编号 | 实验内容 | 实验目的 |
| A | 取两只试管,分别加入4ml 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2ml,向另一只试管中加入0.1mol/L H2C2O4溶液4ml,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
| B | 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。 | 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3 |
| C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。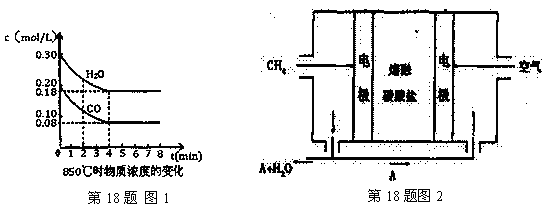
| A.达到平衡时,氢气的物质的量是0.12mol |
| B.达到平衡时,反应体系最终会放出49.44kJ热量 |
| C.在0—4min,混合气体的平均相对分子质量增大 |
| D.第6min时,若升高温度,反应平衡常数会减小 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H> 0 |
| B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 |
| C.常温下,0.1mol·L-1 CH3COOH溶液pH=1 |
| D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
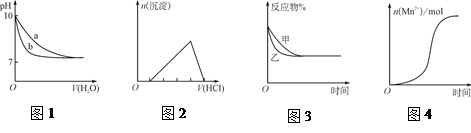
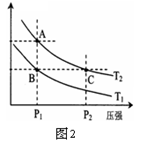
| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 |
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大 CO2(g)+H2(g)的影响,乙的压强比甲的压强大 |
| D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为: OH-(aq)+H+(aq)=H2O(l) ?H =" -a" kJ·mol-1 |
| C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B.在原电池装置中,一定要有两个活泼性不同的金属作为电极材料 |
| C.在化合物中,不是电解质就是非电解质 |
| D.对于可逆反应,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com