
科目: 来源:不详 题型:计算题
 2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。 N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。

查看答案和解析>>
科目: 来源:不详 题型:计算题
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
 CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.催化剂通过降低化学反应的焓变加快化学反应速率 |
| B.铅蓄电池充电时.标有“一”的电极应与电源的负极相连 |
| C.温度保持不变.向水中加入钠盐对水的电离一定没有影响 |
| D.向醋酸钠溶液中加水稀释时.溶液中所有离子浓度都减小 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
 CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母)
CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母) CH4(g)+ H2O (g)
CH4(g)+ H2O (g) HCOOCH3(g) △H=-29.1 kJ·mol-1
HCOOCH3(g) △H=-29.1 kJ·mol-1
查看答案和解析>>
科目: 来源:不详 题型:填空题

 HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol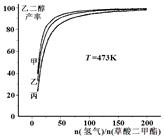
 H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和 。
H++C2O42-和 。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用电解法精炼粗铜的时候纯铜做阳极 |
| B.将镁块与钢铁输水管相连,可以防止钢铁腐蚀 |
| C.熔融烧碱的时候,不能使用石英坩埚 |
| D.可以用硫酸或者CO2中和碱性废水 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| B.升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 |
| C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 |
| D.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl |
查看答案和解析>>
科目: 来源:不详 题型:填空题
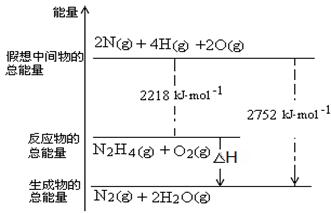
 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
| A.2c1>1.5mol·L-1 | B.w3=w1 | C.2ρ1=ρ2 | D.K甲= K乙= K丙 |
查看答案和解析>>
科目: 来源:不详 题型:单选题




| A.向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,图1虚线表示加入CuSO4溶液时氢气体积与时间的关系 |
| B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- |
| C.向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图3中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 |
| D.由图4可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com