
科目: 来源:不详 题型:填空题
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。

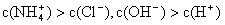

 NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)查看答案和解析>>
科目: 来源:不详 题型:填空题
 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 H2=" —771.1" kJ·mol-1
H2=" —771.1" kJ·mol-1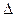 H3=" 482.2" kJ·mol-1
H3=" 482.2" kJ·mol-1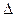 H= kJ·mol-1。
H= kJ·mol-1。 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。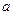 的代数式表示NH3·H2O的电离常数Kb= 。
的代数式表示NH3·H2O的电离常数Kb= 。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.在船舶的外壳装上铜块可防止其发生电化学腐蚀 |
| B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 |
| C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积减小 |
| B.反应NH3(g)+HCl(g)="=NH4Cl(s)" △H<0,低于一定温度自发,高于一定温度非自发 |
| C.铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol |
| C.温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 |
| D.若溶液中存在c(H+)=c(OH-)=10-6 mol/L,则该溶液一定呈中性 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率 |
| B.已知反应SO2(g)+H2O(g)=H2SO3(l),该过程熵值增大 |
C.下图可表示爆炸反应的能量变化曲线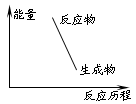 |
| D.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
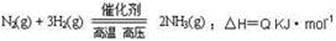
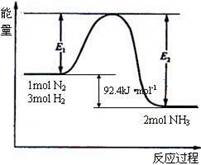
查看答案和解析>>
科目: 来源:不详 题型:填空题
 。
。 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图 表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为 ,平衡时压强为起始压强的 倍。
表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为 ,平衡时压强为起始压强的 倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com