
科目: 来源:不详 题型:填空题

 为例)、人工固氮(以
为例)、人工固氮(以 为
为 的值如下表。
的值如下表。


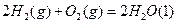

 可以与水反应,则反应
可以与水反应,则反应 +
+ =
= +3/2
+3/2 的
的

 的
的 ,
, 和
和 随时间变化的关系如图所示。
随时间变化的关系如图所示。 将增大
将增大 的浓度变化表示)v(
的浓度变化表示)v( )= .
)= . =
= ,则反应的平衡常数K=(用代数式表示).
,则反应的平衡常数K=(用代数式表示).查看答案和解析>>
科目: 来源:不详 题型:填空题
 N2+2CO2。
N2+2CO2。 N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为: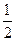 O2(g)=2CO2(g) △H=一283 kJ/mol
O2(g)=2CO2(g) △H=一283 kJ/mol N2(g)+2CO2(g)△H= kJ/mol。
N2(g)+2CO2(g)△H= kJ/mol。 N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是 。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是 。 出行
出行查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.需要加热才能发生的反应一定都是吸热反应 |
| B.任何放热反应在常温下都会发生 |
| C.在原电池中,电能转变成化学能 |
| D.共价化合物中一定没有离子键 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
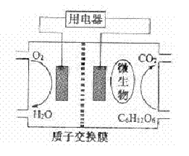
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.4.0g碳化硅晶体中所含C—Si数为0.4NA |
| B.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构 |
| C.电解精炼铜时,当阳极质量减少3.2 g时,电路中转移的电子数为0.1NA |
D.若H+(aq) + OH-(aq)= H2O(l);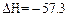 kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 NO(g)+6H2O(g) △H=-bkJ/mol
NO(g)+6H2O(g) △H=-bkJ/mol 则N2(g)+3H2(g) 2NH3(g)的△H= ;
则N2(g)+3H2(g) 2NH3(g)的△H= ;查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后的终止温度 |
| B.由“C(石墨)=C(金刚石);△H=" +119" kJ/mol ”可知金刚石比石墨稳定 |
| C.在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:计算题
 2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:
2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:查看答案和解析>>
科目: 来源:不详 题型:单选题

A.图①表示可逆反应:“CO(g)+H2O(g)  CO2(g)+H2(g)”中的△H大于0 CO2(g)+H2(g)”中的△H大于0 |
| B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1 |
| C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的最也相同 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.在密闭容器中,N2 + 3H2 2NH3达到平衡时的c (NH3)与c (N2) 2NH3达到平衡时的c (NH3)与c (N2) |
| B.0.1 mol / L Na2CO3溶液中的c (Na+)与c (CO32-) |
| C.在反应2 H2S + SO2 → 3 S + 2 H2O中被氧化与被还原的硫原子的质量 |
| D.相同温度下,0.2 mol / L 醋酸溶液与0.1 mol / L 醋酸溶液中的c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com