
科目: 来源:不详 题型:实验题
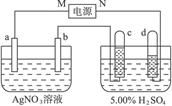
查看答案和解析>>
科目: 来源:不详 题型:实验题


查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:填空题

 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
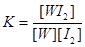
查看答案和解析>>
科目: 来源:不详 题型:单选题
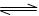 2NH3 (g) △H<0。下列分析正确的是 ( )
2NH3 (g) △H<0。下列分析正确的是 ( )| A.平衡后加入N2,该反应的△H增大 |
| B.若平衡昏升高温度,则平衡常数K变大 |
| C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大 |
| D.若反应前充人的N2与H2物质的量相等,达平衡时N2的转化率比H2的高 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题



| A.微粒半径: K+>Cl->S2->Na+ | B.稳定性:HI> HBr>HCl>HF | C.酸性: HClO4>H2SO4>H3PO4>H4SiO4 | D.熔点:金刚石>NaCl>SiO2>Na |
查看答案和解析>>
科目: 来源:不详 题型:填空题
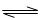 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)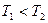 )
)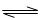 N2(g)+O2(g)为(填“吸热”或“放热) 反应。
N2(g)+O2(g)为(填“吸热”或“放热) 反应。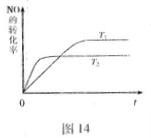
 N2(g)+O2(g)已达到平衡的是(填序号) 。
N2(g)+O2(g)已达到平衡的是(填序号) 。查看答案和解析>>
科目: 来源:不详 题型:单选题
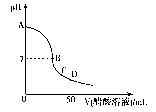
| A.在A点,溶液的pH=13 |
| B.在B点,c(Na+)=c(CH3COO一)>c(OH一)=c(H+) |
| C.在C点,c(Na+)>c(CH3COO-)>c(H+)>c(OH一) |
| D.在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com