
科目: 来源:不详 题型:单选题
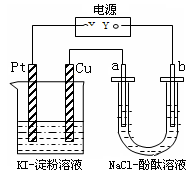
| A.若a极变红,则在Pt电极上:2I--2e-=I2淀粉遇碘变蓝 |
| B.若b极变红,在Pt电极上:4OH--4e-=2H2O+O2O2将I-氧化为I2,淀粉遇碘变蓝 |
| C.若a极变红,在Cu电极上:Cu-2e-→Cu2+,2Cu2++4I-=2CuI↓+I2,一段时间后淀粉遇碘变蓝 |
| D.若b极变红,在Cu极上:Cu-2e-═Cu2+,Cu2+显蓝色 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
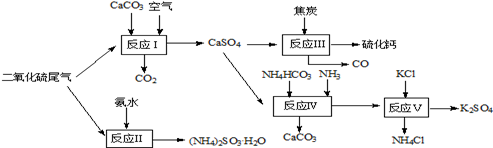
| A.滴有酚酞的NaOH溶液 | B.酸性KMnO4 |
| C.滴有淀粉的碘水 | D.BaCl2溶液. |
查看答案和解析>>
科目: 来源:不详 题型:填空题
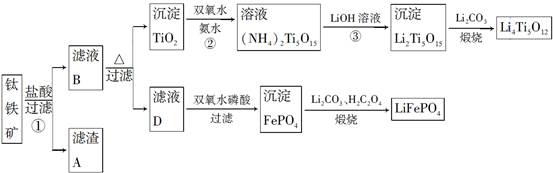
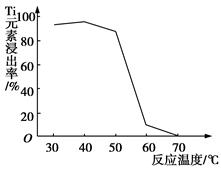
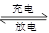 Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。查看答案和解析>>
科目: 来源:不详 题型:单选题
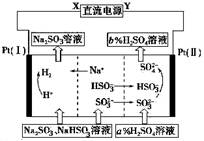
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
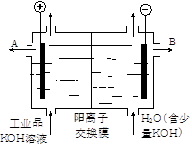
| A.该电解槽的阳极反应式是4OH--2e-→2H2O+ O2↑ |
| B.通电开始后,阴极附近溶液pH会减小 |
| C.除去杂质后氢氧化钾溶液从液体出口A导出 |
| D.用氯化钾制备氢氧化钾也可采用这种离子交换膜电解法 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
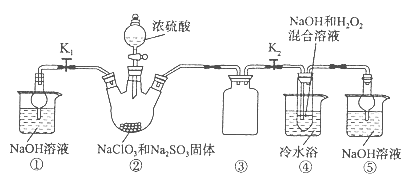
 KIO3 + 3H2↑。下列说法中正确的是
KIO3 + 3H2↑。下列说法中正确的是 | A.电解时石墨作阴极 |
| B.电解时阳极上产生H2 |
| C.电解过程中阴极区溶液pH升高 |
| D.阴极电极反应式:I-- 6e-+ 3H2O = IO3-+ 6H+ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
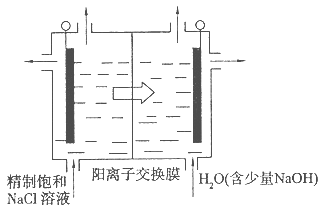
查看答案和解析>>
科目: 来源:不详 题型:单选题
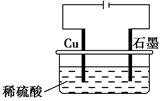
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
科目: 来源:不详 题型:填空题



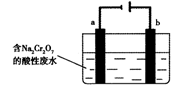
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.3 mol | B.4 mol | C.5 mol | D.6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com