
科目: 来源:不详 题型:问答题
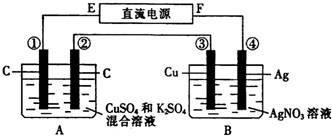
查看答案和解析>>
科目: 来源:不详 题型:填空题
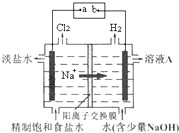
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.消耗硫酸亚铁的物质的量为n(2-x)mol | ||
B.处理废水中的Cr2O72-的物质的量为
| ||
| C.反应中发生转移的电子数为3nxmol | ||
| D.在FeO?FeyCrxO3中,3x=y |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.电解时石墨电极应与直流电源的正极相连 |
| B.阴极反应式为:HOOCCOOH+2H++2e-═OHCCOOH+H2O |
| C.电解时石墨电极上有O2放出 |
| D.电解一段时间后,硫酸溶液的pH不变化 |
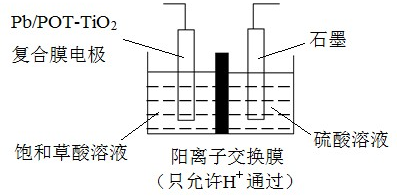
查看答案和解析>>
科目: 来源:不详 题型:问答题
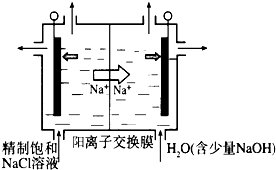
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 时间/min | 0 | 10 | 20 | 30 | 60 |
| pH | 4 | 3 | 2 | 1 | 1 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| ||
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.1:1 | B.2:1 | C.3:1 | D.4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com