
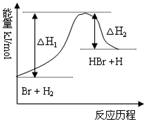
科目: 来源:不详 题型:单选题
| A.正反应为吸热反应 |
| B.加入催化剂,该反应的反应热增大 |
| C.正反应的反应热为△H1 |
| D.加入催化剂,△H1减小,△H2增大 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.甲烷的标准燃烧热为△H=-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B.已知H2O(l)=H2O(g)△H=+44kJ?mol-1,则2g H2(g)完全燃烧生成液态水比生成气态水多释放22kJ的能量 |
| C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H相同 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.反应①的产物比反应②的产物稳定 |
| B.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
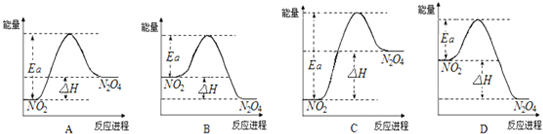
科目: 来源:不详 题型:单选题
| A.将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由“C(石墨)→C(金刚石);△H=+119KJ?mol.L-1”可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l KJ?mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.3 KJ |
| D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8 KJ 热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=+285.8 KJ?mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:多选题
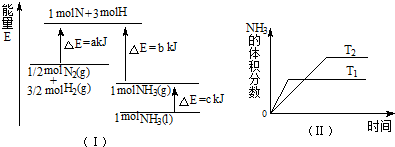
A.该反应的热化学方程式:
| ||||
| B.该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ?mol-1 | ||||
| C.其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 | ||||
| D.Tl>T2,且正反应为放热反应. |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.2△H和2K | B.-2△H和 K2 | C.-2△H和 K-2 | D.2△H和-2K |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mo1/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/moI/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
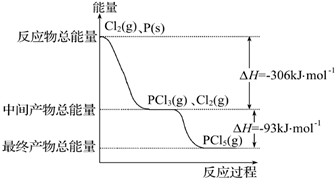
| A.其他条件不变,升高温度有利于PCl5生成 |
| B.反应2P(s)+5Cl2(g)═2PCl5(g)对应的反应热△H=-798 kJ?mol-1 |
| C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)═2PCl3(g)△H=-306 kJ?mol-1 |
| D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com