
科目: 来源:不详 题型:单选题
| A.用AgNO3溶液鉴别NaCl和Na2SO4 |
| B.除去苯中少量苯酚,向混合物中加入足量的NaOH溶液后过滤 |
| C.将碘水和CCl4倒入分液漏斗,振荡后静置,可将碘萃取到CCl4中 |
| D.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
查看答案和解析>>
科目: 来源:不详 题型:填空题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、短颈玻璃漏斗 | 苯甲酸的重结晶 |
| B | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中少量NaI |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5 mol/L NaCl溶液 |
| D | 烧杯、玻璃棒、胶头滴管 | 用盐酸除去BaSO4中少量BaCO3 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
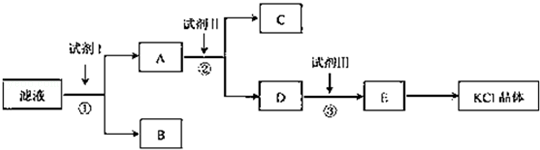
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用溴水鉴别苯和正已烷 |
| B.用BaCl2溶液鉴别SO42﹣与SO32﹣ |
| C.用浓HNO3与Cu反应制备NO2 |
| D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
查看答案和解析>>
科目: 来源:不详 题型:填空题
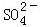 +2H2O
+2H2O
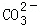 ?CaCO3(s)+
?CaCO3(s)+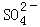
查看答案和解析>>
科目: 来源:不详 题型:实验题
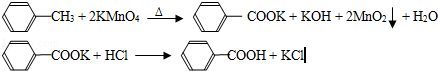
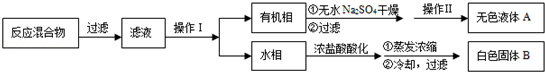
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, _________ _________ | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, _________ | 生成白色沉淀 | 滤液含Cl﹣ |
| ③ | 干燥白色晶体, _________ | _________ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:单选题
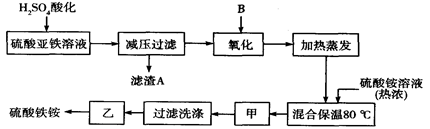
查看答案和解析>>
科目: 来源:不详 题型:填空题
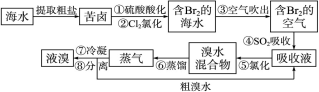
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com