
科目: 来源:不详 题型:单选题
| A.硫酸铜溶液 | B.盐酸 | C.稀硝酸 | D.硝酸银溶液 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
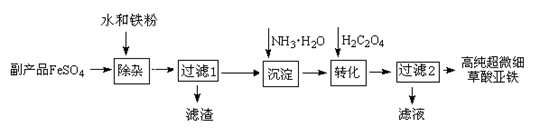
查看答案和解析>>
科目: 来源:不详 题型:单选题
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 |  |
| B | 检验某盐是否为铵盐 |  |
| C | 证明酸性条件H2O2氧化性比I2强 |  |
| D | 除去氯化钠晶体中少量硝酸钾 |  |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:实验题
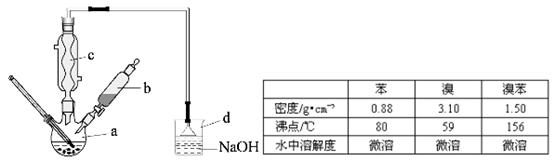
查看答案和解析>>
科目: 来源:不详 题型:单选题
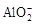 、
、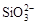 、
、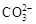 、
、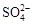 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验: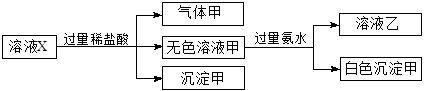
| A.气体甲一定是纯净物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
C.K+、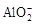 和 和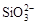 一定存在于溶液X中 一定存在于溶液X中 |
D.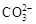 和 和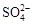 一定不存在于溶液X中 一定不存在于溶液X中 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 在密闭容器中加热CuO | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
| B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
| D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目: 来源:不详 题型:实验题

| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
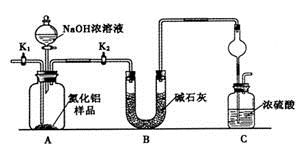
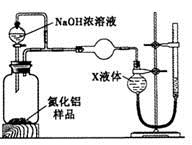
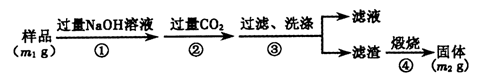
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com