
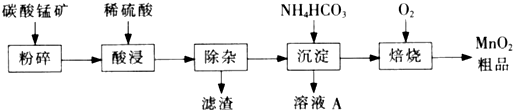
科目: 来源:不详 题型:填空题

| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Al3+ | 3. 0 | 5. 0 |
| Fe2+ | 5. 8 | 8. 8 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
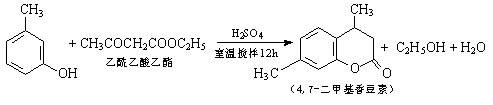
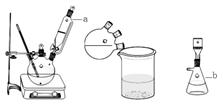
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.试管中盛酚酞溶液,验证氨气的水溶液呈碱性 |
| B.试管中盛酸性高锰酸钾溶液,探究SO2的还原性 |
| C.试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 |
| D.试管中盛淀粉KI溶液,验证氯气的氧化性 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。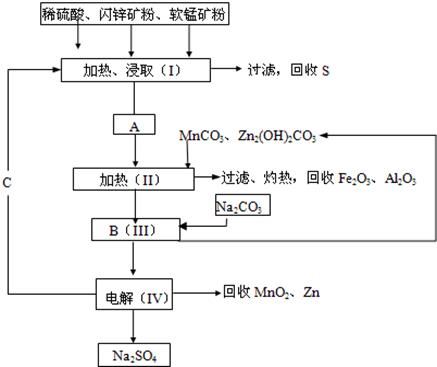
查看答案和解析>>
科目: 来源:不详 题型:填空题
 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:| 氢氧化物 | Al(OH)2 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
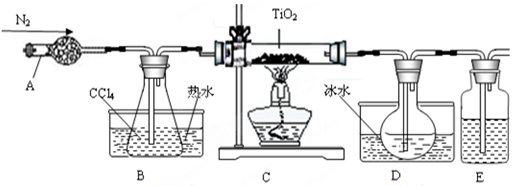
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)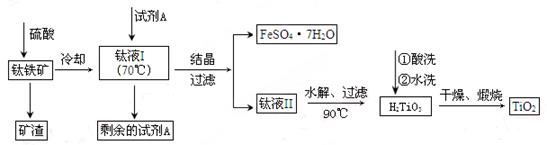
查看答案和解析>>
科目: 来源:不详 题型:单选题
| | 实验目的 | 操作 |
| A | 检验淀粉水解产物有还原性 | 淀粉溶液和稀H2SO4混合加热,冷却后,再加新制的Cu(OH)2悬浊液加热至沸腾 |
| B | 证明SO2具有漂白性 | 将SO2通入溴水中 |
| C | 为了提取溴水中的溴 | 加入植物油进行萃取 |
| D | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
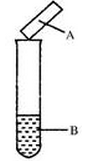
| 选项 | 试剂B | 湿润的 试纸A | 现象 | 结论 |
| A | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | Cu,浓硝酸 | KI-淀粉 试纸 | 变蓝 | NO2为 酸性气体 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

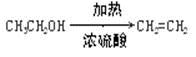
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com