
科目: 来源:不详 题型:填空题
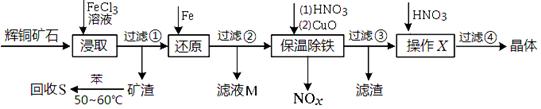
查看答案和解析>>
科目: 来源:不详 题型:填空题


查看答案和解析>>
科目: 来源:不详 题型:单选题
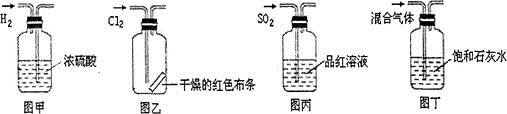
| A.图甲所示,可得到干燥的氢气 |
| B.图乙所示,可以验证氯气的漂白性 |
| C.图丙所示,可以验证SO2的漂白性 |
| D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.盐酸 | B.Na2CO3溶液 |
| C.氯水 | D.FeCl3溶液 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.混合气→a→e→e→b→d→c |
| B.混合气→c→d→e→e→a |
| C.混合气→a→e→b→a→d→c |
| D.混合气→b→e→a→d→c |
查看答案和解析>>
科目: 来源:不详 题型:实验题
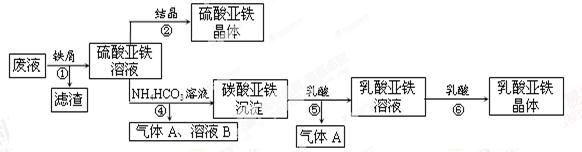
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用酒精萃取碘水中的碘 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
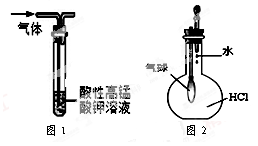
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置能除去SO2中混有的CO2 |
| C.用图2装置能验证HCl气体在水中的溶解性 |
| D.用25 mL碱式滴定管量取20.00 mLKMnO4溶液 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.可用Ba(OH)2溶液鉴别(NH4)2CO3、Na2SO4、NH4NO3三种氮肥 |
| B.MgCl2溶液、NaOH溶液、H2SO4溶液、CuSO4溶液,不加任何试剂即可鉴别 |
| C.NH4Cl和NaCl两种固体物质的分离可用加热法 |
| D.CuO粉末、炭粉、铁粉三种黑色粉末,用一种试剂无法鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com