
科目: 来源:不详 题型:单选题
| | 实验目的 | 实验操作 |
| A | 证明乙烯能发生加成反应 | 将乙烯气体通入溴的四氯化碳溶液中 |
| B | 鉴别Fe(OH)3胶体和FeCl3溶液 | 用激光笔分别照射两种物质,从侧面观察是否出现光亮的通路。 |
| C | 检验酒精中是否含有水 | 取少量酒精加入无水硫酸铜粉末 |
| D | 鉴别苯、环已烯和已烷 | 加入酸性高锰酸钾溶液 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.用图1所示装置可制取氨气 |
| B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.用图3所示装置可制取乙烯并验证其易被氧化 |
| D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
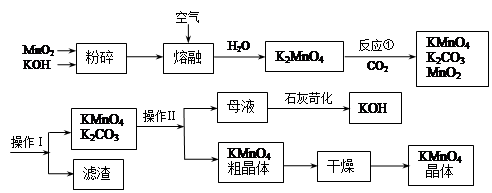
科目: 来源:不详 题型:实验题
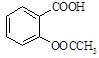 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: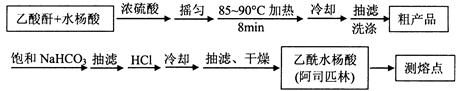
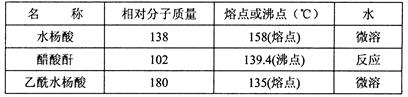
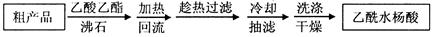
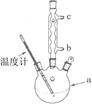
查看答案和解析>>
科目: 来源:不详 题型:填空题
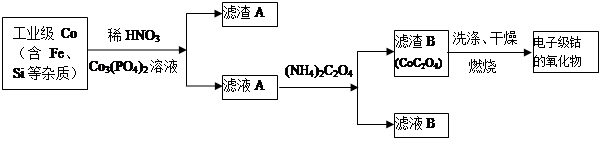
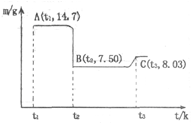
查看答案和解析>>
科目: 来源:不详 题型:填空题
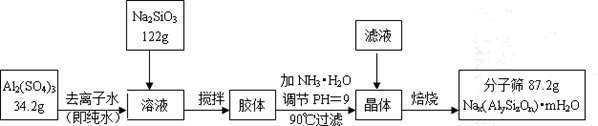
查看答案和解析>>
科目: 来源:不详 题型:填空题
 2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4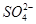 +2H2O
+2H2O
 ?
? CaCO3(s)+
CaCO3(s)+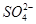
查看答案和解析>>
科目: 来源:不详 题型:单选题
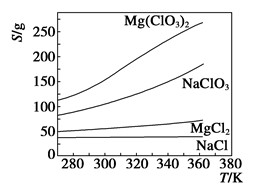
| A.将NaCl溶液蒸干可得NaCl固体 |
| B.将MgCl2溶液蒸干可得MgCl2固体 |
| C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 |
| D.可用MgCl2和NaClO3制备Mg(ClO3)2 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
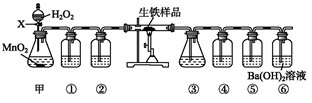
查看答案和解析>>
科目: 来源:不详 题型:填空题
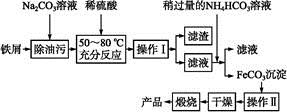
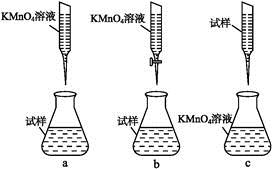
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com