
科目: 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某钠盐溶液中加入过量盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液为Na2CO3溶液 |
| B | 在有镀层的铁片上,用刀刻一槽,在槽上滴入少量0.1 mol/L盐酸,一段时间后滴入KSCN溶液,无红色出现 | 一定是镀锡的马口铁片 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 | 抵制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 向等浓度的NaCl和KI的混合溶液中,逐滴加入AgNO3溶液,溶液中先产生黄色沉淀,后产生白色沉淀 | Ksp(AgCl)< Ksp(AgI) |
查看答案和解析>>
科目: 来源:不详 题型:实验题
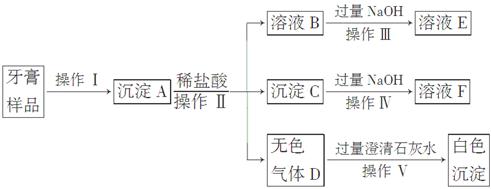
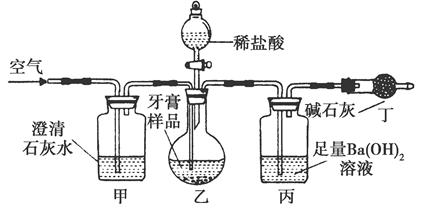
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题

| 物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm—3、20 ℃) | 溶解性 | |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 | |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 | |

查看答案和解析>>
科目: 来源:不详 题型:填空题
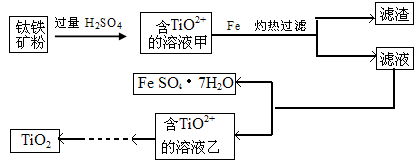
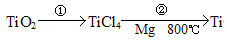
查看答案和解析>>
科目: 来源:不详 题型:填空题
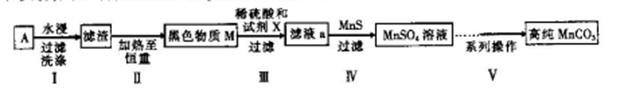

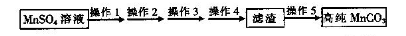
 已除干净; 操作4:___________________;
已除干净; 操作4:___________________; 查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.图1所示装置可制取氨气 |
| B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.图3所示装置可制取乙烯并验证其易被氧化 |
| D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| | 实验目的 | 实 验 步 骤 及 现 象 |
| A | 检验亚硫酸钠试 样是否变质 |  |
| B | 检验某盐是否为铵盐 |  |
| C | 证明酸性条件 H2O2氧化性比I2强 |  |
| D | 除去氯化钠晶体中少量硝酸钾 |  |
查看答案和解析>>
科目: 来源:不详 题型:填空题
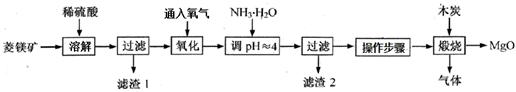
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑; MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com