
科目: 来源:不详 题型:实验题
| 温度物理溶解度 | 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | 60 ℃ |
| FeSO4·7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4·FeSO4·6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体 |
| B.溶剂蒸发的速度越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 |
| C.海带中碘元素的分离及检验时,需要向海带灰的浸取液中,加入少量稀硫酸和过氧化氢溶液 |
| D.纸层析法分离铁离子和铜离子实验中,点样后的滤纸需晾干后,才能将其浸入展开剂中 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 实验操作、现象 | 实验结论 |
| A | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置 | 氧化性:Fe3+>Br2>I2 |
| B | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象 | 铁钉表面形成了一层致密稳定的氧化膜 |
| C | 向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失 | 该溶液中有SO42- |
| D | 甲苯中滴入少量浓溴水,振荡,静置,溴水层褪色 | 萃取了浓溴水中的溴 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
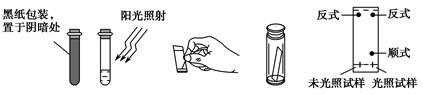
查看答案和解析>>
科目: 来源:不详 题型:实验题

| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
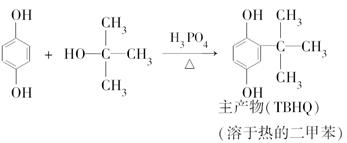
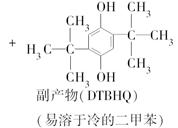
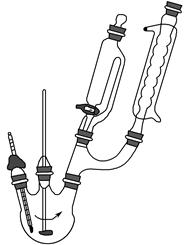
查看答案和解析>>
科目: 来源:不详 题型:实验题
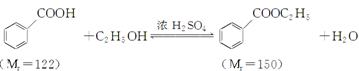
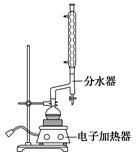
| | 颜色、状态 | 沸点(℃) | 密度(g·cm-3) |
| *苯甲酸 | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

查看答案和解析>>
科目: 来源:不详 题型:填空题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
| 沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
查看答案和解析>>
科目: 来源:不详 题型:实验题


| A.50 mL | B.100 mL | C.200 mL | D.250 mL |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com