
科目: 来源:不详 题型:实验题
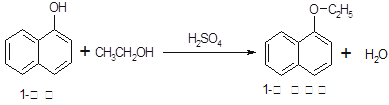
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
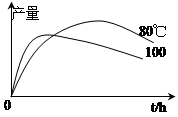
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用溴水鉴别苯和己烷 |
| B.用BaCl2溶液鉴别SO42-和SO32- |
| C.用浓HNO3与Cu 反应制备NO2 |
| D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
查看答案和解析>>
科目: 来源:不详 题型:单选题
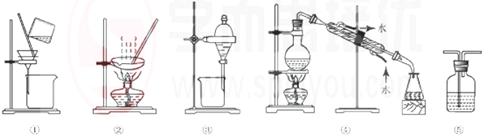
| A.粗盐提纯,选①和② |
| B.用CC14提取碘水中的碘,选③ |
| C.分离Na2CO3溶液和CH3COOC2H5,选④ |
| D.用FeC12溶液吸收C12选⑤ |
查看答案和解析>>
科目: 来源:不详 题型:实验题
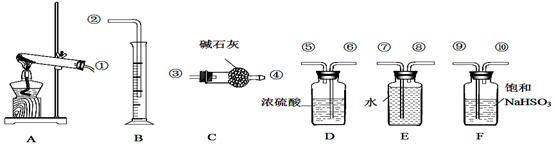
| 实验 小组 | 称取无水CuSO4的质量/g | 仪器C增加的质量/g | 量筒中水的体积折算标准状况下气体的体积/mL |
| ① | 6.4 | 2.56 | 224 |
| ② | 6.4 | 2.56 | 448 |
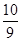 ,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数)
,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数)查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:实验题

 。
。
查看答案和解析>>
科目: 来源:不详 题型:填空题

 CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。查看答案和解析>>
科目: 来源:不详 题型:单选题
| | 操作 | 现 象 | 结 论 |
| A. | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性: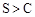 |
| B. | 无色溶液中滴加氯水和CCl4, 振荡、静置 | 下层溶液显紫色 | 原溶液中有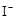 |
| C. | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有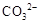 或 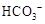 |
| D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有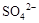 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 物质 | 杂质 | 所用试剂 | 分离方法 |
| A. | KCl | CaCl2 | Na2CO3溶液、盐酸 | 过滤 |
| B. | CH3CH2OH | CH3COOH | CaO | 蒸馏 |
| C. | NaCl | NH4Cl | NaOH | 蒸干 |
| D. | N2 | O2 | 铜网 | 加热 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
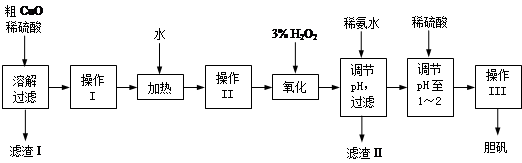
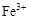 、
、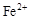 、
、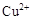 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:| | 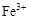 | 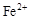 | 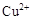 |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| | 第一次实验 | 第二次实验 |
| 坩埚质量(g) | 14.520 | 14.670 |
坩埚质量 晶体质量(g) 晶体质量(g) | 17.020 | 18.350 |
| 第一次加热、冷却、称量(g) | 16.070 | 16.989 |
| 第二次加热、冷却、称量(g) | 16.070 | 16.988 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com