
科目: 来源:不详 题型:单选题

| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
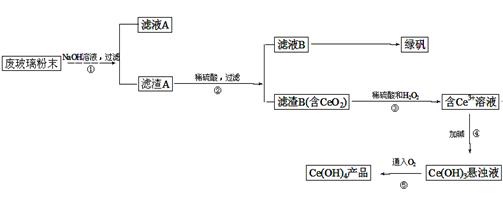
查看答案和解析>>
科目: 来源:不详 题型:填空题
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.氨水 | B.AgNO3 | C.NaOH | D.BaCl2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 |
| 步骤:2:另取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 若 , 则假设3成立。 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
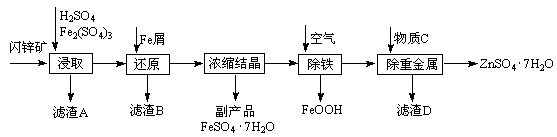
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
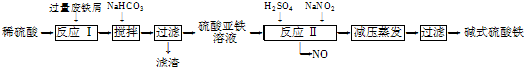
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A. | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
| B. | 向无色溶液中加硝酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中定含SO42- |
| C. | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2CO3的酸性比H2SiO3强 |
| D. | 向某溶液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中定含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com