
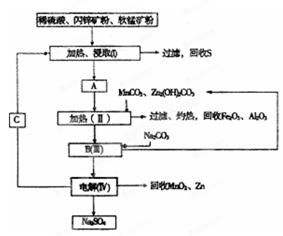
科目: 来源:不详 题型:填空题
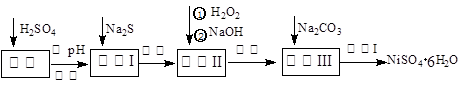
查看答案和解析>>
科目: 来源:不详 题型:实验题
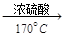 CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个):
CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个): 
查看答案和解析>>
科目: 来源:不详 题型:实验题

| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
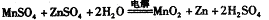
查看答案和解析>>
科目: 来源:不详 题型:单选题
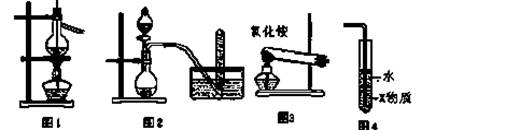
| A.图1用于海水蒸馏 | B.图2用于铜与浓硝酸反应制取NO2 |
| C.图3用于实验室制氨 | D.图4中X若为四氯化碳,可用于吸收氯化氢气体,并防止倒吸 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

| 操 作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: | |
查看答案和解析>>
科目: 来源:不详 题型:填空题
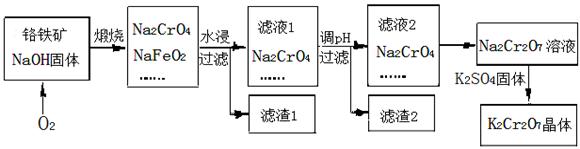
 2CrO42- + 2H+
2CrO42- + 2H+| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
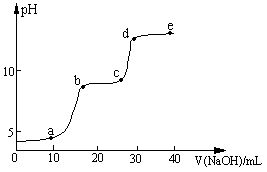
| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.硫酸 | B.盐酸 | C.氨水 | D.氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com