
科目: 来源:不详 题型:计算题
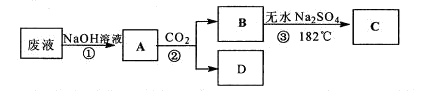
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.用装置①除去Cl2中含有的少量HCl |
| B.用装置②从氯化铁溶液中直接蒸发结晶获得无水氯化铁 |
| C.用装置③制取少量纯净的CO2气体 |
| D.用装置④分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
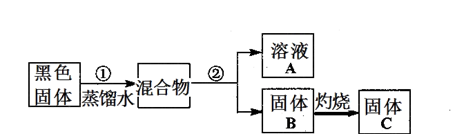
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,__ __________________________ | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管,__________ __________________________ | ______________________ | _______________________ |
| 步骤3:往c试管,__________ __________________________ | 先产生_______________, 后____________________ | 说明溶液A含有Zn2+ |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 | |
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 | 出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, | |
| 步骤4: | |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入 | 现象: 结论: |
| 步骤3:取滤液分装A、B两支试管。向A试管, | 现象:溶液先变红色,然后褪色。 结论: |
| 步骤4:向B试管, | 现象:产生白色沉淀。 结论: |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 |
| B.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体 |
| C.用品红和盐酸检验Na2SO3和Na2CO3 |
| D.将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
查看答案和解析>>
科目: 来源:不详 题型:实验题
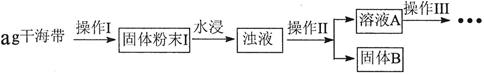
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入______ | 无现象 | 证明不是以IO3ˉ形式存在 |
| ③ | 往试管II中加入_______ | _______________ | 证明以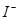 形式存在 形式存在 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
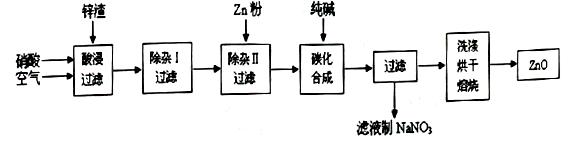
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡.静置后分液,可除去苯中少量苯酚 |
D.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com