
科目: 来源:重庆市高考真题 题型:单选题
查看答案和解析>>
科目: 来源:山西省模拟题 题型:填空题
 又称联氨,是一种可燃性液体,可用作火箭燃料。已知在
又称联氨,是一种可燃性液体,可用作火箭燃料。已知在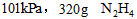 ,在氧气中完全燃烧生成氮气,放出热量
,在氧气中完全燃烧生成氮气,放出热量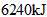 ,(25℃时),完全燃烧反应的热化学方程式是___________________。
,(25℃时),完全燃烧反应的热化学方程式是___________________。
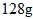 ,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气的体积含量为20%)。
,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气的体积含量为20%)。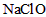 氧化
氧化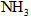 制得肼的稀溶液,该反应的离子方程式是_______________。
制得肼的稀溶液,该反应的离子方程式是_______________。 查看答案和解析>>
科目: 来源:河南省期中题 题型:单选题
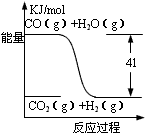
查看答案和解析>>
科目: 来源:专项题 题型:填空题
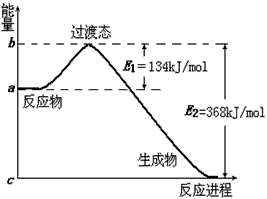
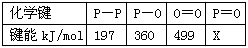
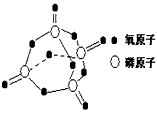
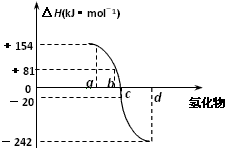
查看答案和解析>>
科目: 来源:0118 月考题 题型:填空题
查看答案和解析>>
科目: 来源:上海高考真题 题型:不定项选择题

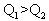
查看答案和解析>>
科目: 来源:北京期末题 题型:填空题
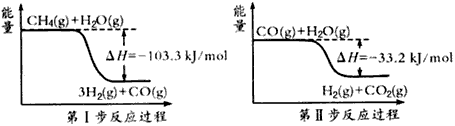
查看答案和解析>>
科目: 来源:湖北省模拟题 题型:单选题

A.12g C(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ/mol
C.该反应的热化学方程式是:2C(s) +O2(g)=2CO(g) △H= -221kJ/mol
D.碳的燃烧热为110. 5 kJ/mol
查看答案和解析>>
科目: 来源:河南省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:上海高考真题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com