
科目: 来源:不详 题型:实验题
| A.Fe3+易水解生成Fe(OH)3,不利于吸收 |
| B.Fe3+易被还原成Fe2+,不便于在空气中保存 |
| C.Fe3+有强氧化性,对人体有腐蚀、刺激作用 |
| D.三价铁有毒 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
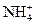 、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。
、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。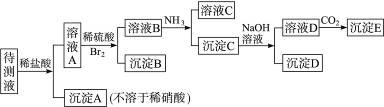
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 编号 | 实验操作 | 预期现象和结论 |
| ① | | |
| ② | | |
| ③ | | |
| ④ | | |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Al(OH)3:铝盐与碱反应 |
| B.Al:电解熔融AlCl3 |
| C.银氨溶液:硝酸银溶液滴入氨水中 |
| D.溴乙烷:乙烷与溴水反应 |
查看答案和解析>>
科目: 来源:不详 题型:判断题
查看答案和解析>>
科目: 来源:不详 题型:实验题
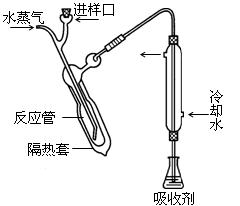
查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:单选题
|
| A.再验证剩余气体是否可燃及燃烧时火焰的颜色 |
| B.将剩余气体还原热的CuO粉末,观察固体颜色的变化 |
| C.将剩余气体通入溴水中,看溴水是否褪色 |
| D.将剩余气体干燥后燃烧,再用无水硫酸铜检验燃烧产物 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
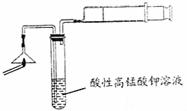
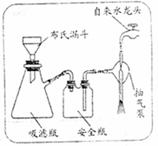
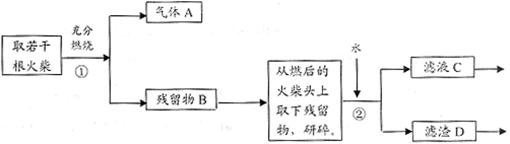
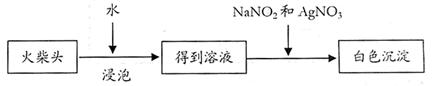
|
| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
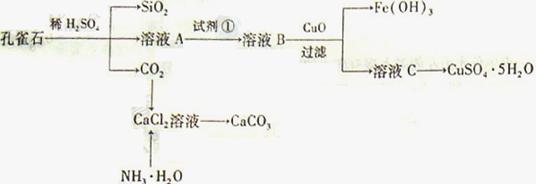

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com