
科目: 来源:不详 题型:实验题
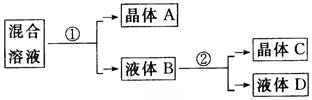
查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Na2CO3、BaCl2、HCl |
| B.BaCl2、Na2CO3、H2SO4 |
| C.BaCl2、Na2CO3、HCl |
| D.Ba(NO3)2、Na2CO3、HCl |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Fe(OH)3胶体(FeCl3溶液):蒸馏水,渗析 |
| B.KCl (I2 ) 固体:加热,升华 |
| C.NaC1 (KNO3 ) :配成饱和溶液,降温结晶 |
| D.CO2(SO2 ) :通过饱和NaHCO3溶液、浓硫酸 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+ |
| B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明有I- |
| C.往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32— |
| D.往溶液中加入 BaC12溶液和稀 HNO3 ,有白色沉淀生成,说明有SO42- |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.可用激光笔区别淀粉溶液和食盐溶液 |
| B.加入盐酸以除去硫酸钠中的少许碳酸钠杂质 |
| C.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| D.除去BaSO4固体中混有的BaCO3:加过量硫酸后,过滤、洗涤 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

查看答案和解析>>
科目: 来源:不详 题型:实验题
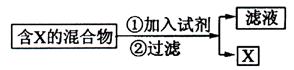
 (1)
(1) (2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。 ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________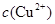 逐渐下降,
逐渐下降,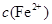 、
、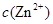 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的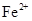 、
、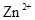 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。| 物质 |  | 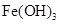 | 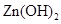 | 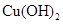 |
溶度积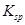 | 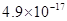 | 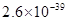 | 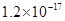 | 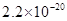 |
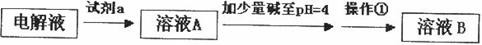
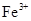 生成
生成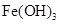 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①②③④ | B.③①②④ | C.④③②① | D.③②①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com