
科目: 来源:不详 题型:单选题
| A.①② | B.②④ | C.③④ | D.②③ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①②③⑤ | B.②④⑤ | C.③④⑤ | D.②③⑥ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.除去甲烷中混有的少量乙烯:氢气 |
| B.除去乙酸乙酯中混有的少量乙酸:乙醇 |
| C.除去溴苯中混有的少量溴单质:氢氧化钠溶液 |
| D.除去苯中混有的少量苯酚:浓溴水 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.加70℃以上的热水,分液 | B.加适量浓溴水,过滤 |
| C.加足量NaOH溶液,分液 | D.加适量FeCl3溶液,过滤 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
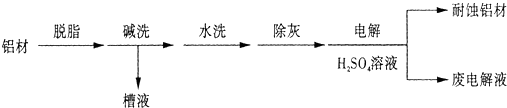
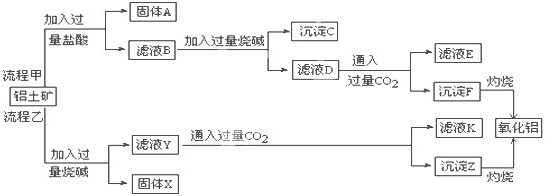
查看答案和解析>>
科目: 来源:不详 题型:问答题
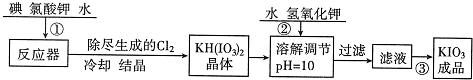
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol?L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol?L-1的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
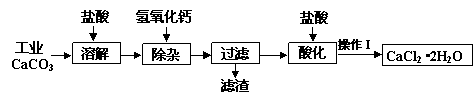
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com