
科目: 来源:不详 题型:实验题
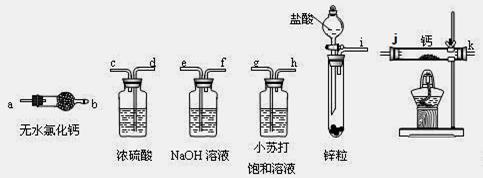
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
查看答案和解析>>
科目: 来源:不详 题型:计算题
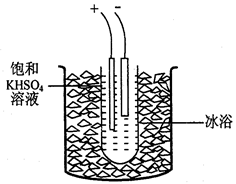
 I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)查看答案和解析>>
科目: 来源:不详 题型:填空题
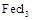 易升华。工业上制备无水的
易升华。工业上制备无水的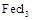 的一种工艺如图所示:
的一种工艺如图所示: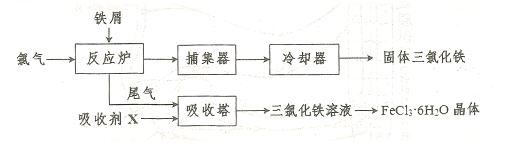
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。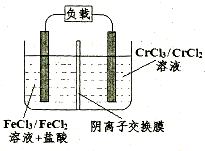
查看答案和解析>>
科目: 来源:不详 题型:实验题
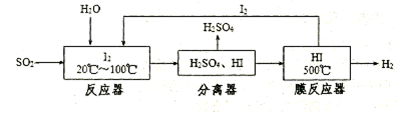
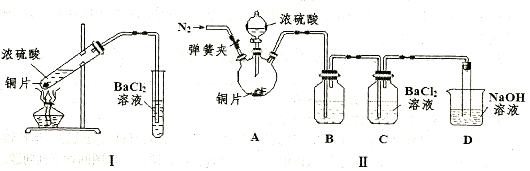
查看答案和解析>>
科目: 来源:不详 题型:实验题
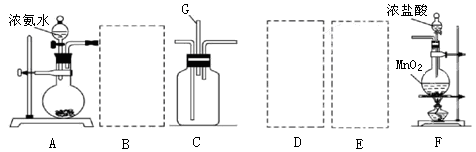

查看答案和解析>>
科目: 来源:不详 题型:填空题
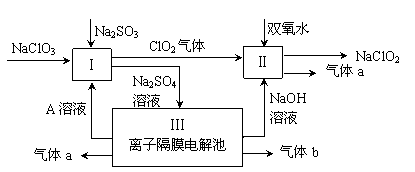
查看答案和解析>>
科目: 来源:不详 题型:实验题
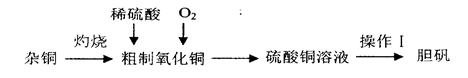
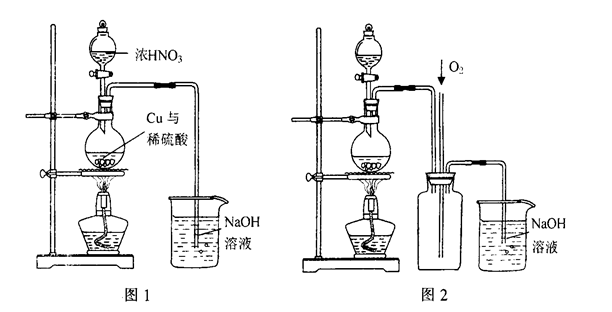
查看答案和解析>>
科目: 来源:不详 题型:实验题
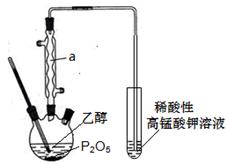

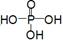 )__________________________________。
)__________________________________。查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com