
科目: 来源:不详 题型:实验题
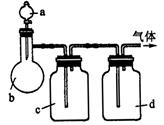
| 气体 | a | b | c | d |
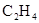 | 乙醇 | 浓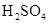 | 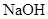 溶液 溶液 | 浓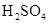 |
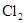 | 浓盐酸 | 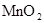 | 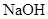 溶液 溶液 | 浓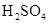 |
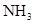 | 饱和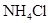 溶液 溶液 | 消石灰 | 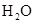 | 固体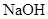 |
| NO | 稀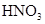 | 铜屑 | 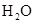 | 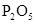 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 |
| B.乙烷中混有乙烯,通H2在一定条件下反应,使乙烯转化为乙烷 |
| C.硝基苯中混有浓H2SO4和浓HNO3,将其倒入NaOH溶液中,静置,分液 |
| D.乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
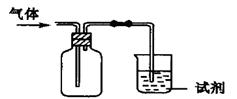
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
| B | NH3 | 水 | 无明显现象 | NH3能溶于水 |
| C | X | 澄清石灰水 | 溶液变浑浊 | 气体可能是CO2 |
| D | SO2 | 酸性KMnO4(aq) | 溶液褪色 | SO2有漂白性 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
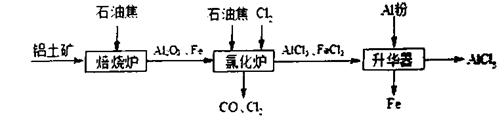
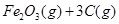
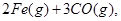
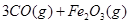

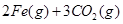 。则反应②的平衡常数的表达式为K= 。
。则反应②的平衡常数的表达式为K= 。查看答案和解析>>
科目: 来源:不详 题型:填空题
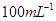 标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量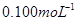 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: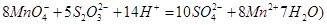
查看答案和解析>>
科目: 来源:不详 题型:实验题
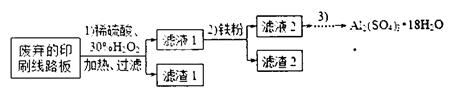
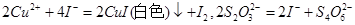
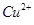 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏
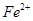 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
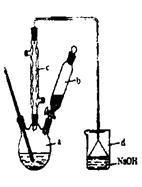
| | 苯 | 溴 | 溴苯 |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。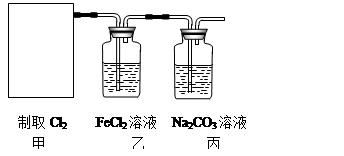
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.②⑥③⑦⑤ | B.④③⑤⑦⑥ | C.①③⑦⑤⑥ | D.②⑤⑦⑥ |
查看答案和解析>>
科目: 来源:不详 题型:实验题
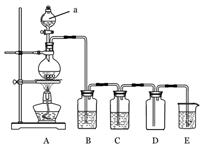
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com