
科目: 来源:不详 题型:实验题
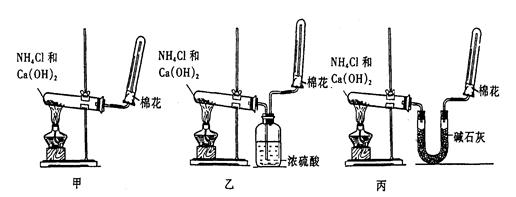
查看答案和解析>>
科目: 来源:不详 题型:实验题

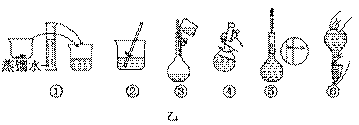
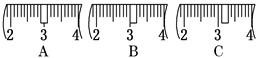
 NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母).
NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母).| | a | b | c | d | e |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:填空题

 间构型为 。
间构型为 。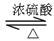 CH3COOC2H5+H2O
CH3COOC2H5+H2O| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |

| 同一反应时间 | 同一反应应温度 | ||||
反应温度/ ℃ ℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物全部是乙酸乙酯和水 | |||||
查看答案和解析>>
科目: 来源:不详 题型:实验题
 (2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必
(2)在下面方框中,A表示有分液漏斗和圆底烧瓶组成的气体发生器,请在虚线框内的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必 画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如
画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如 下:
下: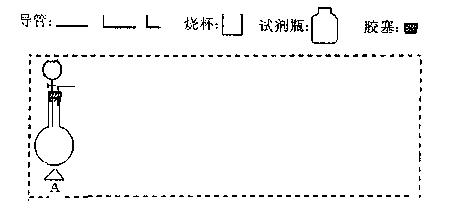
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | MnO2、浓盐酸 | MnO2与浓盐酸生成Cl2 |
| | | |
| | | |
| | | |
| | | |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.将25g CuSO4·5H2O溶于1L水中,可配制成0.1 mol·L-1CuSO4溶液 |
| B.用盐析法除去氢氧化铁胶体中混有的氯离子 |
| C.用向下排空气法收集NH。,并用湿润的蓝色石蕊试纸检验NH。是否收集满了 |
| D.制乙炔时,用饱和食盐水代替水是为了减缓电石与水的反应速率 |
查看答案和解析>>
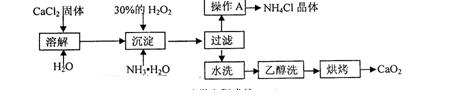
科目: 来源:不详 题型:实验题

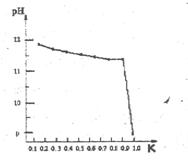
查看答案和解析>>
科目: 来源:不详 题型:填空题
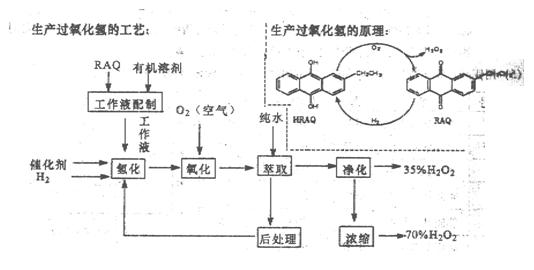
查看答案和解析>>
科目: 来源:不详 题型:填空题
 等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
| A.利用上述反应原理可制备高纯铁 |
| B.制备Fe(CO)5应在隔绝空气的条件下进行 |
C.反应Fe(s)+5CO(g)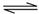 Fe(CO)5(g)的平衡常数表达式为 Fe(CO)5(g)的平衡常数表达式为 |
| D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存。 |
 溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。
溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。 。
。查看答案和解析>>
科目: 来源:不详 题型:实验题
 确程序 。
确程序 。| A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸 馏水 馏水 |
| C.转移溶液后的烧杯未经多次洗涤 |
| D.胶头滴管加水后定容时仰视刻度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com