
科目: 来源:不详 题型:实验题
| 配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸 | → | 用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL |
| A.①②⑤⑥ | B.②④⑤⑥⑦ | C.②①⑥⑦ | D.②④⑤⑥ |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 组别 | 被选出的物质 | 分类依据 |
| 第①组 | | |
| 第②组 | | |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.容量瓶中原有少量的蒸馏水 |
| B.移液时,没有洗涤烧杯和玻璃棒 |
| C.溶解后没有冷却就转移到容量瓶中 |
| D.定容时俯视观察刻度线和液面 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为______g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器有________________ |
| (3)将KCl放入到100 mL烧杯中加水溶解 | 为加快溶解速度,可采取的措施是______________________ |
| (4)将烧杯中的溶液转移至500 mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________ |
| (5)向容量瓶中加蒸馏水到刻度线 | 在进行此操作时应注意的问题是__________________________ |
查看答案和解析>>
科目: 来源:不详 题型:实验题
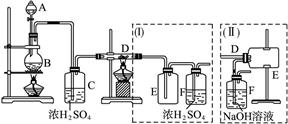
查看答案和解析>>
科目: 来源:不详 题型:计算题
 +4HCl(浓)
+4HCl(浓) MnCl
MnCl +2H
+2H O+Cl
O+Cl ↑。现将4.35 g MnO
↑。现将4.35 g MnO 跟足量36%的盐酸充分反应后,生成的氯气为多少克?
跟足量36%的盐酸充分反应后,生成的氯气为多少克?查看答案和解析>>
科目: 来源:不详 题型:实验题
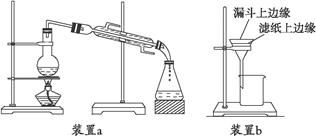
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:实验题
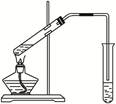
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com