
科目: 来源:不详 题型:问答题

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用萃取的方法可将汽油和煤油进行分离 |
| B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 |
| C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 |
| D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
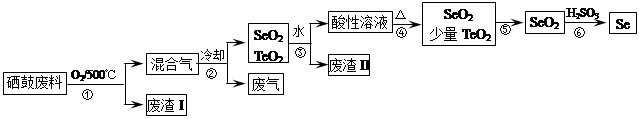
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐溶液滴入AgNO3溶液 | 有白色沉淀 | 该钠盐不一定是NaCl |
| B | 浓硫酸与NaCl固体混合加热 | 有气体产生 | 硫酸的酸性比HCl强 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液 | 出现黄色沉淀 (PbI2) | KSP(PbI2)<KSP(PbCl2) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C | 确定碳、氯两元素非金属性的强弱 | 测定同温同浓度的Na2CO3和NaClO水溶液的pH |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 浓氨水 | 生石灰 | AgNO3溶液 | 无明显现象 | NH3与AgNO3溶液不反应 |
| B | 盐酸 | 碳酸钠 | BaCl2溶液 | 变浑浊 | 盐酸酸性强于碳酸 |
| C | 饱和食盐水 | 电石 | 酸性KMnO4溶液 | 紫色褪去 | 乙炔可被KMnO4氧化 |
| D | 浓硫酸 | 亚硫酸钠 | 溴水 | 橙色褪去 | SO2具有漂白性 |

查看答案和解析>>
科目: 来源:不详 题型:实验题


查看答案和解析>>
科目: 来源:不详 题型:问答题
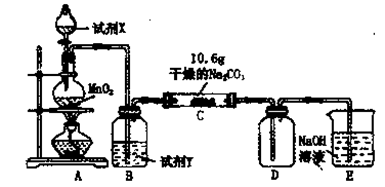
 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。查看答案和解析>>
科目: 来源:不详 题型:实验题
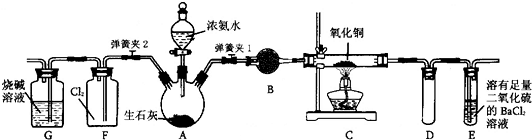
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com