
科目: 来源:不详 题型:实验题

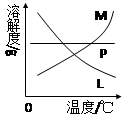
查看答案和解析>>
科目: 来源:不详 题型:实验题

| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 0.40 | 20.40 |
| 第2次 | 20.00 | 4.00 | 24.00 |
| 第3次 | 20.00 | 0.10 | 22.10 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
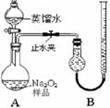
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
 水解液
水解液 中和液
中和液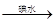 溶液变蓝
溶液变蓝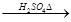 水解液
水解液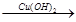 无红色沉淀
无红色沉淀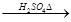 水解液
水解液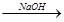 中和液
中和液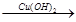 有红色沉淀
有红色沉淀查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.将氢氧化钠固体放在滤纸上称量 |
| B.用10ml量筒量取8.58ml蒸馏水 |
| C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
| D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.银镜反应实验后附有银的试管,可用稀H2SO4清洗 |
| B.在中学《硫酸铜晶体里结晶水含量测定》的实验,称量操作至少需要四次 |
| C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗 |
| D.在250ml 烧杯中,加入216g水和24g NaOH固体,配制10% NaOH溶液 |
查看答案和解析>>
科目: 来源:不详 题型:实验题



查看答案和解析>>
科目: 来源:不详 题型:实验题
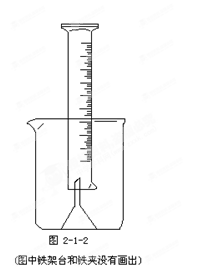
查看答案和解析>>
科目: 来源:不详 题型:填空题
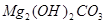 、
、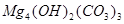 、
、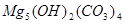 等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
等。请你设计一个测定碱式碳酸镁组成的实验方案。包括查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com