
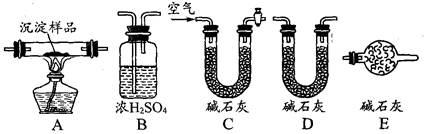
科目: 来源:不详 题型:实验题
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
对某品牌牙膏中摩擦剂成分及其含量进行以下探究: __________________________________________。
__________________________________________。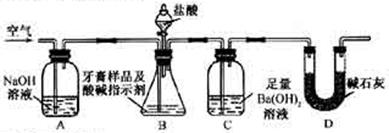
 ___。
___。 酸钙的质量分数为__________。
酸钙的质量分数为__________。查看答案和解析>>
科目: 来源:不详 题型:实验题
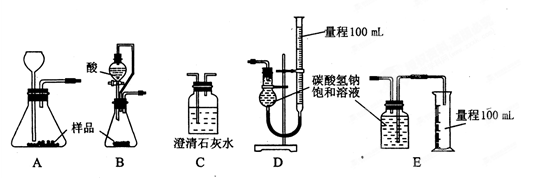
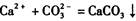 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.碱式滴定管用蒸馏水洗净后,直接加入未知浓度的NaOH溶液 |
| B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D.滴定前读数正确,达到滴定终点后,俯视读数 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| A.纯碱 | B.烧碱 | C.胆矾 | D.醋酸钠 (E) KHSO4 |

查看答案和解析>>
科目: 来源:不详 题型:填空题
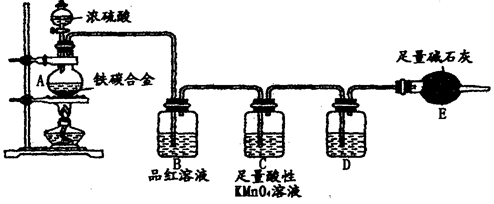

查看答案和解析>>
科目: 来源:不详 题型:实验题
 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。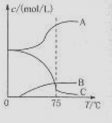
 NaC1O3+3H2↑
NaC1O3+3H2↑ HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 选项 | 实验操作、现象 | 解释、结论 |
| A. | 铜片放入浓硫酸中,无明显变化 | 铜在冷的浓硫酸中会发生钝化 |
| B. | 往某氯化物溶液中滴加氨水,产生白色沉淀 | 该氯化物是AlCl3 |
| C. | 将10ml某pH=3的HA溶液加水稀释到100ml,所得溶液pH=3.8 | HA是弱酸 |
| D. | 往MgCl2溶液中滴加NaOH溶液,调至pH=9时,开始出现沉淀[已知Mg(OH)2的Ksp=5.6×10-12] | 原溶液中 c(Mg2+)=5.6×10-2mol·L-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C.用PH试纸测定某无色溶液的PH时,应将PH试纸放入溶液中,观察其颜色变化,跟标准比色卡比较 |
| D.蒸馏操作中,温度计应该放在蒸馏烧瓶内的液体中,以测量液体的温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com