
科目: 来源:不详 题型:实验题
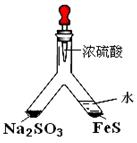
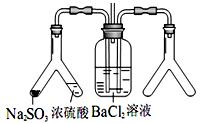
 验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。
验目的:探究 SO2与BaCl2反应产生沉淀的条件。二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧 Y型管中应放置的药品是____________和___________(必要时可以加热),该沉淀的化学式为________________。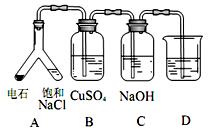
 证电石气的主要成分,D中盛放______________。
证电石气的主要成分,D中盛放______________。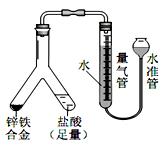
查看答案和解析>>
科目: 来源:不详 题型:实验题
 CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑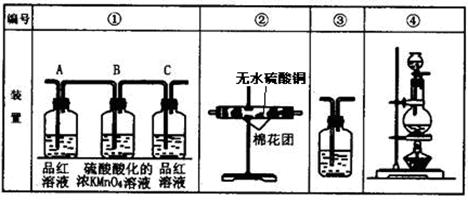
 接顺序(按产物气流从左到右的方向)是(填装置的编号):
接顺序(按产物气流从左到右的方向)是(填装置的编号): ④ →__________→__________→__________。
④ →__________→__________→__________。| A.BaCl2溶液 | B.Ba(OH)2溶液 |
| C.滴加H2O2的BaCl2溶液 | D.滴加H2O2的Ba(OH)2溶液 |
 增重质量为bg。用a、b表示CO2和SO2的物质的量比 。
增重质量为bg。用a、b表示CO2和SO2的物质的量比 。查看答案和解析>>
科目: 来源:不详 题型:填空题
 管壁上有“银镜”出现
管壁上有“银镜”出现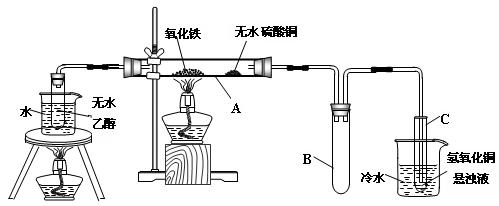
 2)实验中可观察到石英管A中的现象为 。
2)实验中可观察到石英管A中的现象为 。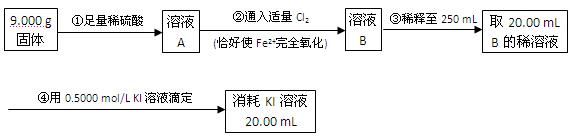
查看答案和解析>>
科目: 来源:不详 题型:实验题
 越大。
越大。
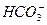 + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7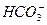

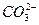 +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11 H++
H++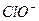 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8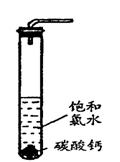
 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
查看答案和解析>>
科目: 来源:不详 题型:实验题
| | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.40mL | 18.50mL |
| 第二次 | 1.30mL | 18.05mL |
| 第三次 | 3.10mL | 21.20mL |
 色到 色;
色到 色;| A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.未用标准液润洗碱式滴定管 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
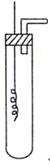
 向下移动插入试管液体中,使之与硝酸反应,反应的离子方程式是 ;
向下移动插入试管液体中,使之与硝酸反应,反应的离子方程式是 ;
查看答案和解析>>
科目: 来源:不详 题型:单选题
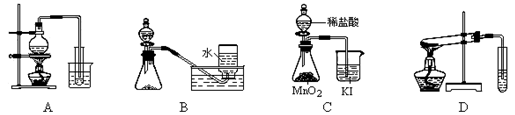
| A.制取少量蒸馏水 | B.用铜和浓硝酸制取少量NO2 |
| C.比较MnO2、Cl2、I2的氧化性 | D.探究NaHCO3的热稳定性 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。完成以下实验探究过程:
mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。完成以下实验探究过程: 作、预期现象和结论。
作、预期现象和结论。| 编号 | 实验操作 | 实验现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量  ____ 溶液并滴加到试管A中,充分反应 ____ 溶液并滴加到试管A中,充分反应 | 有固体剩余,并有气泡产生 | 合金中除铝外还含有Fe、Cu 元素 |
| ② | 往试管A的剩余固体中加过量 ________ ,充分反应后,静置,取上层清液于试管B中 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | |
| ③ | 往试管B中加入少量 _____,再滴加KSCN溶液 | _____ | |
| ④ | 往②剩余固体中加入稀硝酸;再滴加 ____________ 溶液. | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色;再加某溶液后有蓝色沉淀产生 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
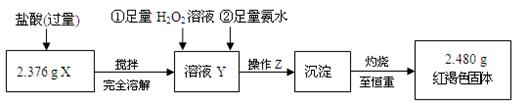
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少 量红色物质析出,仍有较多黑色固体未溶解 量红色物质析出,仍有较多黑色固体未溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com