
科目: 来源:不详 题型:填空题
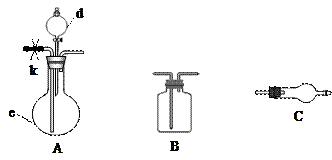
| 各装置连接次序 | | A | | | C | C |
| 对应的药品 | | d:浓盐酸 e:固体混合物 | | | 碱石灰 | 碱石灰 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
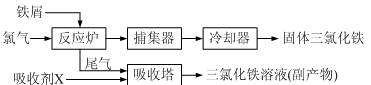
查看答案和解析>>
科目: 来源:不详 题型:实验题




 +IBr →
+IBr → ②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr ③I2+2S2O32-=2I-+S4O62-


查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
 在一支洁净的试管内混合后,向其中又加入0.5mL乙醛溶液,然后水浴加热,结果无红色
在一支洁净的试管内混合后,向其中又加入0.5mL乙醛溶液,然后水浴加热,结果无红色 沉淀出现,该同学实验失败的原因可能是 ( )
沉淀出现,该同学实验失败的原因可能是 ( )| A.加入乙醛太多 | B.加入乙醛太少 |
| C.加入NaOH溶液的量不够 | D.加入CuSO4溶液的量不够 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
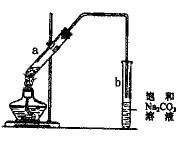
| A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加乙酸 |
| B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 |
| C.制得的乙酸乙酯是一种无色透明、有香味的油状液体 |
| D.向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
 (一)甲组:实验方案:镁铝合金
(一)甲组:实验方案:镁铝合金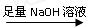 测定剩余固体质量
测定剩余固体质量 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末 (二)乙组:实验方案:镁铝合金
(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积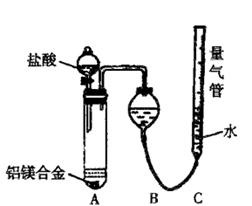

 并最终得到固体物质1.45g。则该合金中铝的质量分数为 。
并最终得到固体物质1.45g。则该合金中铝的质量分数为 。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.在进行中和滴定是,先固定沉定管,后润洗、装液 |
| B.测定硫酸铜晶体的结晶水含量时,先称取一定量的晶体,后放入坩埚 |
| C.为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 |
| D.实验室抽取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
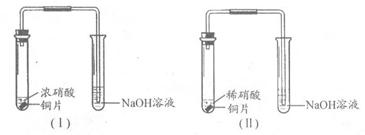
查看答案和解析>>
科目: 来源:不详 题型:单选题
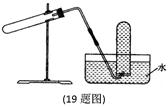
| A.加热CaCO3制CO2 |
| B.用Cu与稀HNO3反应制NO |
| C.用NH4Cl和浓NaOH溶液反应制NH3 |
| D.用NaCl与浓H2SO4反应制HC1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com