
科目: 来源:不详 题型:填空题
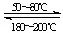
查看答案和解析>>
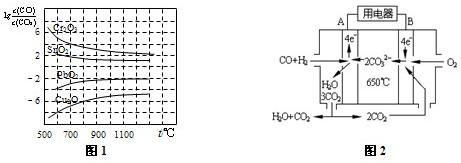
科目: 来源:嘉兴模拟 题型:填空题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?Lˉ1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |



查看答案和解析>>
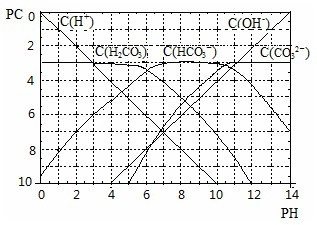
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 1 |
| 2 |
| A.+283.5kJ?mol-1 | B.+172.5kJ?mol-1 |
| C.-172.5kJ?mol-1 | D.-504kJ?mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
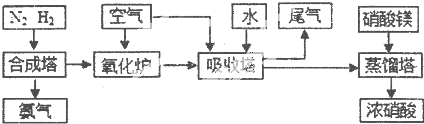
| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 2 |
查看答案和解析>>
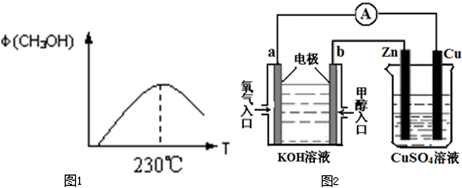
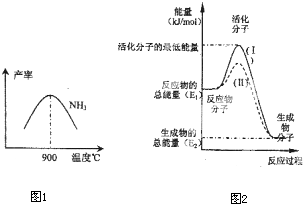
科目: 来源:不详 题型:问答题
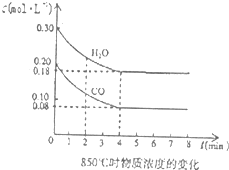
查看答案和解析>>
科目: 来源:不详 题型:多选题
| A.△H3=-0.33 kJ?mol-1 |
| B.正交硫比单斜硫稳定 |
| C.单斜硫比正交硫稳定 |
| D.1mol S(单斜,s)和1mol O2(g)的总能量低于1mol SO2(g)的能量 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 1 |
| 2 |
| A.-283.01 kJ?mol -1 | B.+504.00 kJ?mol -1 |
| C.+283.01 kJ?mol -1 | D.+172.51 kJ?mol -1 |
查看答案和解析>>
科目: 来源:枣庄一模 题型:问答题
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 1 |
| 2 |
| A.△H=-488.3 kJ/mol | B.△H=+244.1 kJ/mol |
| C.△H=-996.6 kJ/mol | D.△H=+996.6 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com