
科目: 来源:不详 题型:实验题
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4·2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | — |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g·cm-3) | 1.900 | 1.650 |
 华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题: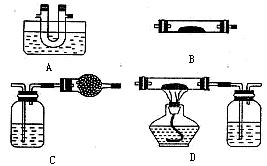
| A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 |
| B.测定相同浓度的草酸和硫酸溶液的pH |
| C.测定草酸钠(Na2C2O4)溶液的pH |
| D.将草酸溶液加入Na2CO3溶液中,有CO2放出 |
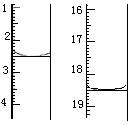
查看答案和解析>>
科目: 来源:不详 题型:实验题
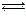 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
| A.2v(NH2)=v(CO2) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
 NH4HCO2+NH3?H2O
NH4HCO2+NH3?H2O
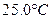 时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。
时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。查看答案和解析>>
科目: 来源:不详 题型:实验题
 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。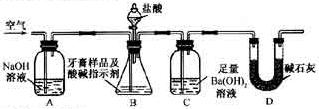
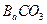 质量,只要测定装置C在吸收
质量,只要测定装置C在吸收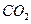 前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______.
前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______.查看答案和解析>>
科目: 来源:不详 题型:实验题
 等离子的卤水为主要原料制备无水
等离子的卤水为主要原料制备无水 和
和 ,流程如下:
,流程如下:
 。
。 。由表中数据可知,理论上可选择pH最大范围是 。酸化溶液Z时,使用的试剂为 。
。由表中数据可知,理论上可选择pH最大范围是 。酸化溶液Z时,使用的试剂为 。
 气体,下列装置中合理的是 。
气体,下列装置中合理的是 。
 的电离常数
的电离常数 ,
, ,
, 的电
的电 离常数
离常数 ,
, 。某同学设计实验验证
。某同学设计实验验证 酸性强于
酸性强于 :将
:将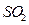 和
和 气体分别通入水中至饱和,立即用酸度计测两溶液的
气体分别通入水中至饱和,立即用酸度计测两溶液的 ,若前者的
,若前者的 小于后者,则
小于后者,则 酸性强于
酸性强于 。该实验设计不正确,错误在于 。
。该实验设计不正确,错误在于 。 酸性强于
酸性强于 (简要说明实验步骤、现象和结论)。 。仪器器自选。
(简要说明实验步骤、现象和结论)。 。仪器器自选。 、
、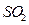 、
、 、
、 、
、 、
、 、蒸馏水、饱和石灰水、酸性
、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、
溶液、品红溶液、 试纸。
试纸。查看答案和解析>>
科目: 来源:不详 题型:实验题
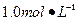 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
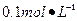 Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀。
Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀。 盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。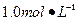 Ba(OH)2溶液。
Ba(OH)2溶液。查看答案和解析>>
科目: 来源:不详 题型:实验题
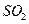 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中  产生白色沉淀,液面上放略显浅棕色并逐渐消失 产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | ___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。查看答案和解析>>
科目: 来源:不详 题型:实验题
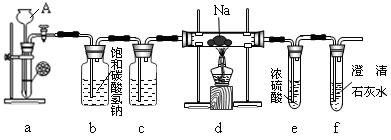
查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:实验题
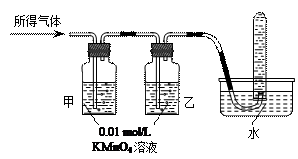 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com