
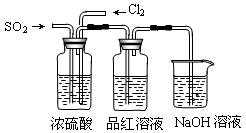
科目: 来源:不详 题型:实验题
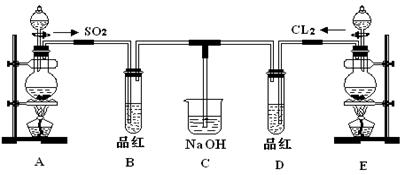
查看答案和解析>>
科目: 来源:不详 题型:单选题
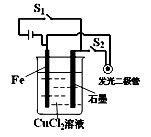
| A.断开开关S1,按下开关S2,化学能转化为电能,电能转化为光能等 |
| B.断开开关S1,按下开关S2,此时构成的装置属于电解池 |
| C.断开开关S2,按下开关S1,此时构成的装置属于原电池 |
| D.断开开关S2,按下开关S1,化学能转化为电能 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
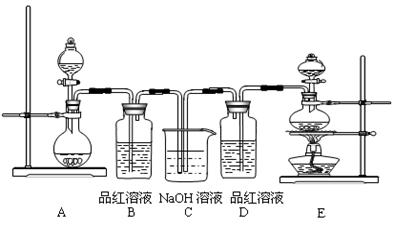
查看答案和解析>>
科目: 来源:不详 题型:填空题
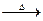 CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
 CH3COOH+Cu2O↓+2H2O”质疑的理由:
CH3COOH+Cu2O↓+2H2O”质疑的理由:查看答案和解析>>
科目: 来源:不详 题型:实验题
| 方案 | 实验操作 | 预期现象及结论 |
| 1 | 取少量黄色溶液,加入NaOH溶液 | 若生成红褐色沉淀,则甲正确 |
| 2 | 取少量黄色溶液,加入淀粉KI溶液 | 若溶液变蓝色,则乙正确 |
| 3 | 取少量黄色溶液,加入苯溶液,振荡后静置 | 若上层溶液呈橙红色,则 正确 |
 (用离子方程式表示),
(用离子方程式表示),| 实验操作 | 预期现象及结论 |
| | |
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+
溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+| 滴定次数 | 待测草酸溶液体积(mL) | 0.1000 mol/LKMnO4标准溶液体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 10.02 |
| 第二次 | 25.00 | 0.22 | 11.32 |
| 第三次 | 25.00 | 1.56 | 11.54 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
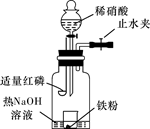
 则假设2正确;
则假设2正确;查看答案和解析>>
科目: 来源:不详 题型:填空题
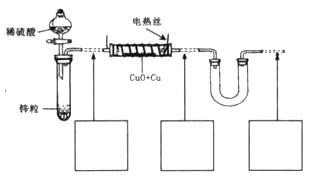
 B.无水硫酸铜粉 C.无水氯化钙颗粒
B.无水硫酸铜粉 C.无水氯化钙颗粒
查看答案和解析>>
科目: 来源:不详 题型:填空题
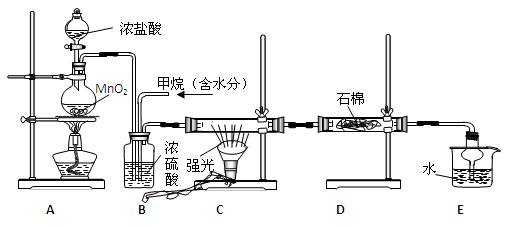

| A.水洗分液法 | B.蒸馏法 | C.过滤法 | D.结晶法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com