
科目: 来源:不详 题型:填空题
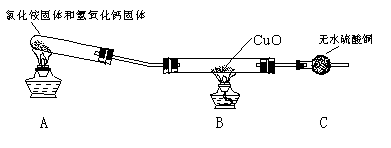
查看答案和解析>>
科目: 来源:不详 题型:实验题
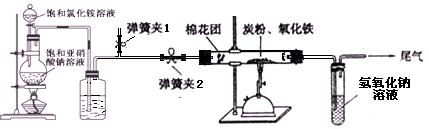 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
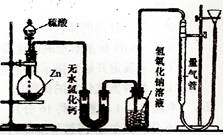 硫酸可以被还原为SO2,也可被还原为氢气。为
硫酸可以被还原为SO2,也可被还原为氢气。为查看答案和解析>>
科目: 来源:不详 题型:实验题
| A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化 |
| B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣 |
| C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却, 再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系 |
| D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色 |
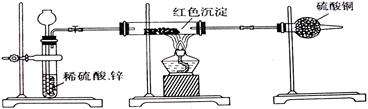
查看答案和解析>>
科目: 来源:不详 题型:实验题
|
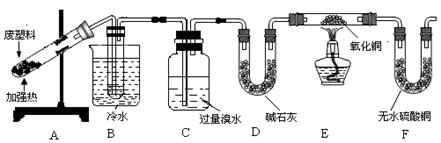
查看答案和解析>>
科目: 来源:不详 题型:计算题
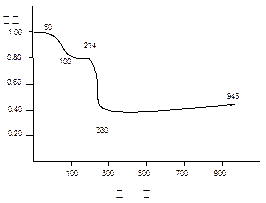
查看答案和解析>>
科目: 来源:不详 题型:计算题
查看答案和解析>>
科目: 来源:不详 题型:实验题

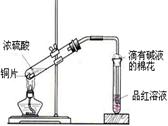
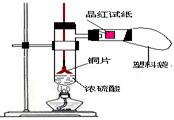
 图1 图2
图1 图2 ①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。 ②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。 回答下列问题:
回答下列问题: (1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ; (2)塑料袋作用是: ;
(2)塑料袋作用是: ; (3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题








查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com