
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.+178.2 kJ?mol-1 | B.-178.2 kJ?mol-1 |
| C.+287.2 kJ?mol-1 | D.-287.4 kJ?mol-1 |
查看答案和解析>>
科目: 来源:不详 题型:问答题

| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目: 来源:肇庆二模 题型:问答题
| 催化剂 |
| 催化剂 |
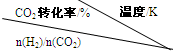 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目: 来源:专项题 题型:单选题
查看答案和解析>>
科目: 来源:浙江省期末题 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2 
查看答案和解析>>
科目: 来源:广东省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:天津期中题 题型:不定项选择题
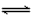 2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)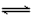 2HI(g) - 26.48 kJ 下列判断正确的是
2HI(g) - 26.48 kJ 下列判断正确的是 [ ]
查看答案和解析>>
科目: 来源:专项题 题型:单选题
查看答案和解析>>
科目: 来源:0115 期末题 题型:填空题
 2C (g)。反应达到平衡时,平衡常数表达式K= ____________ ;在不同温度下达到平衡时生成物C的物质的量如下图所示,则该反应是____________反应(填“放热”或“吸热” )。在500℃,从反应开始到平衡,C的平均反应速率v(C) =___________________。
2C (g)。反应达到平衡时,平衡常数表达式K= ____________ ;在不同温度下达到平衡时生成物C的物质的量如下图所示,则该反应是____________反应(填“放热”或“吸热” )。在500℃,从反应开始到平衡,C的平均反应速率v(C) =___________________。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com