
科目: 来源:不详 题型:填空题
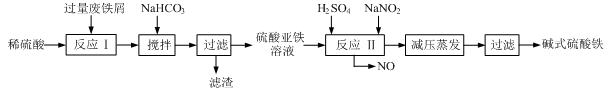
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
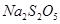 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下: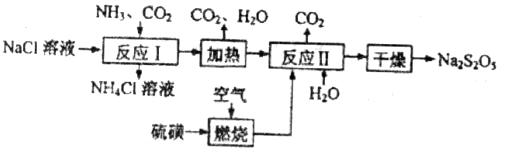
 等多步反应。
等多步反应。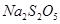 与稀硫酸反应放出
与稀硫酸反应放出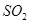 ,其离子方程式为___________。
,其离子方程式为___________。查看答案和解析>>
科目: 来源:不详 题型:单选题
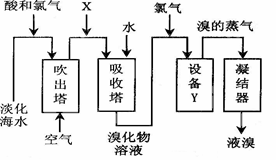
| A.X为SO2气体,也可将SO2换成Na2SO3 |
| B.设备Y为蒸馏塔 |
| C.在提取溴的过程中一定有Br-被氧化 |
| D.工业上每获得1molBr2,需要消耗Cl2的体积最多为22.4L(标准状态下) |
查看答案和解析>>
科目: 来源:不详 题型:填空题
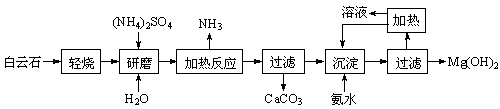
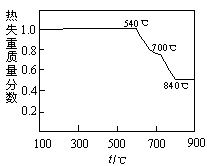
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.2HgO 2Hg+O2↑ 2Hg+O2↑ |
B.4Al+3MnO2 2Al2O3+3Mn 2Al2O3+3Mn |
C.2AlCl3 2Al+3Cl2 ↑ 2Al+3Cl2 ↑ |
D.4CO+Fe3O4 3Fe+4CO2 3Fe+4CO2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
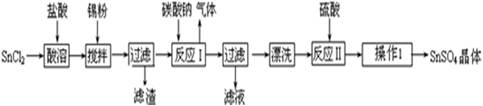

查看答案和解析>>
科目: 来源:不详 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.电解MgCl2饱和溶液,可制得金属镁 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠 |
| D.从海带中提取碘单质的过程不涉及氧化还原反应 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com