
科目: 来源:不详 题型:填空题
 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制
4SiO2)为原材料制 备Li2CO3的工艺流程如下:
备Li2CO3的工艺流程如下: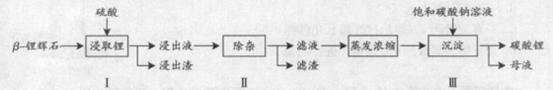
查看答案和解析>>
科目: 来源:不详 题型:填空题
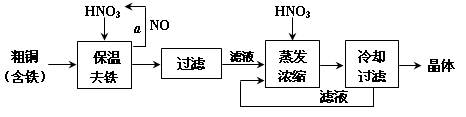
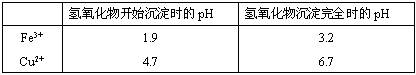
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用明矾净水是因为Al3+水解生成Al(OH)3胶粒具有很强的吸附性 |
| B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率 |
| C.硫酸工业中,在接触室安装热交换器是为了利用硫铁矿燃烧时放出的热量 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
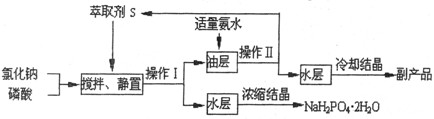
 NaH2PO4+HCl
NaH2PO4+HCl  HCl·S △H<0
HCl·S △H<0 H3PO4·S △H<0
H3PO4·S △H<0
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:填空题
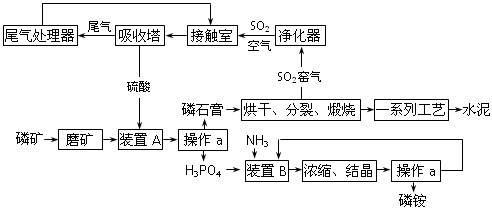
| A.NaOH溶液、酚酞试液 | B.氨水、酚酞试液 |
| C.碘水、淀粉溶液 | D.KMnO4溶液、稀硫酸 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
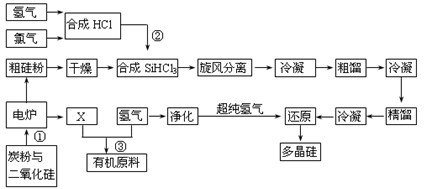
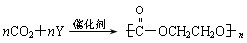 则Y的结构简式为 。
则Y的结构简式为 。
 Si(s)+4HCl(g)
Si(s)+4HCl(g) 查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.(1)(3)(5) | B.(2)(3)(4) | C.(1)(3)(4) | D.(1)(3)(4)(5) |
查看答案和解析>>
科目: 来源:不详 题型:填空题

 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。| A.增大压强 | B.降低温度 | C.使用催化剂 | D.增大反应物的浓度 |
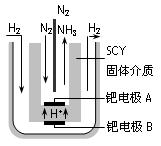
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com