
科目: 来源:不详 题型:计算题
 CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:查看答案和解析>>
科目: 来源:不详 题型:单选题
 2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是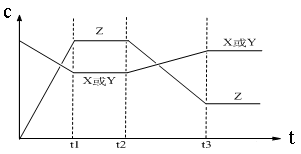
| A.增大X或Y的浓度 | B.增大压强 |
| C.增大Z的浓度 | D.升高温度 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2NO2(g) △H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是
2NO2(g) △H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是
| A.a点 | B.b点 | C.c 点 | D.d点 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.2NO2(g)  N2O4(g)△H<0 N2O4(g)△H<0 |
B.3O2(g) 2O3(g)△H>0 2O3(g)△H>0 |
C.H2(g)+I2(g) 2 H I(g)△H<0 2 H I(g)△H<0 |
D.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g)△H>0 NH3(g)+H2O(g)+CO2(g)△H>0 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2R(g)△H>0,y 轴表示的是
2R(g)△H>0,y 轴表示的是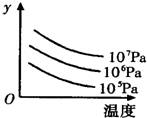
| A.平衡时,混合气中R的百分含量 | B.G的转化率 |
| C.平衡时,混合气中G的百分含量 | D.L的转化率 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是| A.平均相对分子质量减小 | B. C的转化率增大 |
| C. C的质量分数增大 | D.反应热大于原来的2倍 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 xC(g),达平衡后,C在平衡混合气中的体积分数为w。若维持温度不变,按1.2molA、0.4molB、0.6molC为起始物质,达平衡后压强不变,C的体积分数仍为w,则x的值为
xC(g),达平衡后,C在平衡混合气中的体积分数为w。若维持温度不变,按1.2molA、0.4molB、0.6molC为起始物质,达平衡后压强不变,C的体积分数仍为w,则x的值为查看答案和解析>>
科目: 来源:不详 题型:填空题
 R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。
 2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
 CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。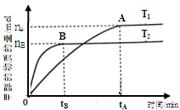
 CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填| A.该反应为放热反应 |
| B.T1时的反应速率大于T2时的反应速率 |
| C.该反应在T1时的平衡常数比T2时的大 |
| D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.温度越高 | B.反应物浓度越小 |
| C.反应进行的越完全 | D.生成物浓度越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com