
科目: 来源:不详 题型:问答题
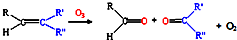
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.反应过程中,若压缩容器体积,增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ |
| C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol/L的NaOH溶液恰好反应 |
| D.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L?min) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| 10 | 0.80 | |
| 20 | 0.20 |
| A.反应在10min内的平均速率为v(H2)=0.04mol?L-1?min-1 |
| B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol |
| C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 |
| D.温度升高至T2℃(T2>T1)时,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
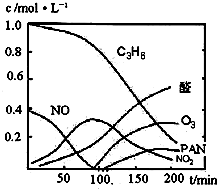
科目: 来源:福建 题型:单选题
| A.在0-50min之间,pH=2和pH=7 时R的降解百分率相等 |
| B.溶液酸性越强,R 的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol?L-1?min-1 |
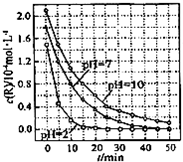
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.4mol/L?min | B.0.8mol/(L?min) |
| C.1.6mol/L?min | D.0.4mol/(L?min) |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 实验 序号 |
温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.
| B.
| ||||
C.
| D.
|
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.v(NH3)=0.6mol?(L?min)-1 | B.v(N2)=1.0mol?(L?min)-1 |
| C.v(H2)=1.67mol?(L?min)-1 | D.v(H2)=0.3mol?(L?min)-1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.分别向盛有5mL0.1mol?L-1Na2CO3溶液、NaHCO3溶液的试管中加入3mL0.1mol?L-1盐酸,后者放出CO2气体快 |
| B.25℃时,一份双氧水样品经过2h,H2O2的浓度从5×10-2mol?L-1下降到3×10-2mol?L-1,该双氧水在这2h中分解的平均速率约是1.67×10-4mol?(L?min)-1 |
| C.用含硫矿石(如黄铁矿)燃烧制二氧化硫气体时,为了增大二氧化硫的生成速率,常将矿石粉碎成颗粒状、在沸腾炉内鼓入强大空气流,把矿石吹得剧烈翻腾 |
| D.H2能在O2中安静地燃烧,点燃H2和空气的混合气体可能会发生爆炸,前者是因为纯净的O2和H2反应较慢,后者是因为空气中含有大量的N2能促进H2的燃烧 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.反应前5秒钟内,用NO表示的平均反应速率为0.1mol?L-1?s-1 |
| B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大 |
| C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2) |
| D.保持容器体积不变,往容器中充入1mol O2,正、逆反应速率都不改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com