
科目: 来源:不详 题型:单选题
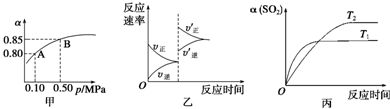
| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.温度升高,H2O(g)的转化率增大 | ||
B.反应的化学平衡常数的表达式为:k=
| ||
C.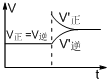 增大压强后,V正、V逆的变化如图所示 | ||
| D.多投些 Fe(s),可有效提高化学反应速率 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L?min) |
| B.反应开始至2分钟时,A的转化率为5% |
| C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0 |
| D.若其他条件不变,增大压强,化学反应速率的变化符合下面示意图 |
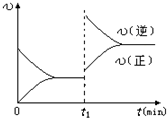
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 反应结束 |
| 2.0mol/L硫酸 | 无明显现象 | 极少量气泡 | 少量气泡 | ||
| 4.0mol/L硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
| 实验目的 | 实验 编号 |
温度 | 金属铝 形态 |
盐酸浓度 /mol?L-1 |
| 1 实验①和②探究盐酸浓度对该反应速率的影响; 2实验①和③探究温度对该反应速率的影响; 3实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① | 25?C | 铝片 | 4.0 |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目: 来源:顺德区模拟 题型:问答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
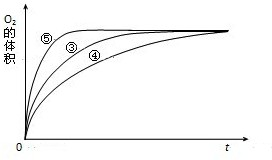
查看答案和解析>>
科目: 来源:不详 题型:单选题
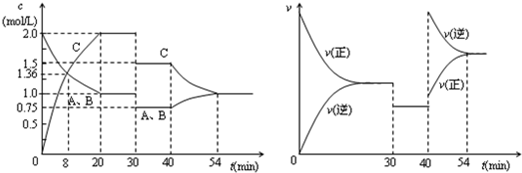
| A.30min时降低温度,40min时升高温度 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.8min前A的平均反应速率为0.08mol/(L?min) |
| D.30min~40min间该反应使用了催化剂 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
 |
 |
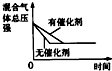 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目: 来源:肇庆一模 题型:多选题
| A.温度升高,H2O(g)的转化率增大 | ||
B.反应的化学平衡常数的表达式为k=
| ||
| C.增大压强后,V正、V逆如图所示 | ||
| D.利用该反应原理可以在铁表面附上一层保护层,减少铁的腐蚀 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com