
科目: 来源:不详 题型:单选题
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以增大生成氢气的速率 |
| B.100 mL 2 mol?L-1盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.汽车尾气中的一氧化氮和一氧化碳可以缓慢反应生成氮气和二氧化碳,使用催化剂可以增大反应速率 |
| D.二氧化硫的催化氧化是一个放热反应,升高温度,反应速率降低 |
查看答案和解析>>
科目: 来源:不详 题型:多选题
| A.对该反应体系加热 | B.加入3mol?L-1的硝酸 |
| C.加入少量氯化钠晶体 | D.不用铁片,改用铁粉 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |

| 4 |
| 7 |

查看答案和解析>>
科目: 来源:珠海一模 题型:问答题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①④ | B.③④ | C.①②③ | D.②③ |
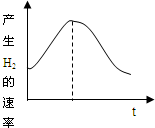
查看答案和解析>>
科目: 来源:江西模拟 题型:单选题
| ||
| A.除①⑦外 | B.除③⑤⑥外 | C.除③⑤外 | D.除③⑥⑦外 |
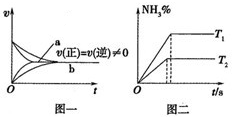
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.m>n,Q<0 | B.m>n+p,Q>0 | C.m>n,Q>0 | D.m<n+p,Q<0 |

查看答案和解析>>
科目: 来源:不详 题型:问答题
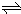
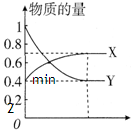
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②⑤ | D.①⑤ |
查看答案和解析>>
科目: 来源:0115 期中题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com