
科目: 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:选择题
下列有关实验现象和解释或结论都正确的选项是( )
选项实验操作现象解释或结论
A把SO2通入紫色石蕊试液中紫色褪去SO2具有漂白性
B把浓硫酸滴到pH试纸上试纸变红浓硫酸具有酸性
C将充满NO2的密闭玻璃球浸泡在热水中红棕色变浅反应2NO2
N2O4的ΔH<0
D向AgCl沉淀中滴加KI溶液白色沉淀
变为黄色溶度积:AgI比
AgCl更小
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:实验题
某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
实验 序号 | 称取CuSO4 的质量/g | 碱石灰的 增加质量/g | 剩余气体的体积(折算 成标准状况下)/mL | 结论 |
Ⅰ | 6.4 |
|
| 假设1成立 |
Ⅱ | 6.4 | 2.88 | 224 |
|
Ⅲ | 6.4 | 2.56 | 448 |
|
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:填空题
Na2S2O3·5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃ 和70 ℃ 时的溶解度分别为60.0 g 和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
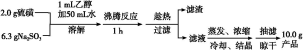
(1)实验开始时用1 mL乙醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫磺的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液 C.水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol/L的标准碘水溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3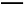 2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:填空题
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
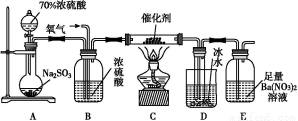
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。
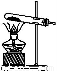
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
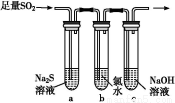
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
往100 mL,pH=0的硫酸和硝酸的混合液中投入3.84 g铜粉,充分反应后,生成NO气体,标准状况下为448 mL,则反应前的混合液中HNO3的物质的量是( )
A.0.02 mol B.0.08 mol
C.0.10 mol D.0.16 mol
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,气体很快变为红棕色。下列对原混合气体成分的判断中正确的是( )
A.肯定只有SO2和NO B.肯定有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
用下列实验装置进行相应实验,能达到实验目的的是( )
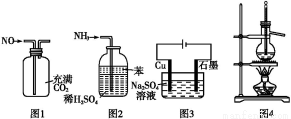
A.用图1所示装置(正放)可收集NO气体
B.用图2所示装置可吸收多余氨气且能防止倒吸
C.用图3所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑
Cu(OH)2+H2↑
D.用图4所示装置可分离乙醇(沸点78.4 ℃)与二甲醚(沸点24.9 ℃)的混合物
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
可用如图所示装置制取、净化、收集的气体是( )
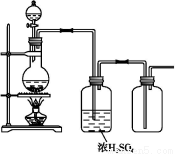
A.锌和稀硫酸反应制氢气
B.浓氨水与氢氧化钙固体反应制氨气
C.亚硫酸钠固体与硫酸反应制二氧化硫
D.铜与稀硝酸反应制一氧化氮
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
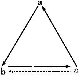
选项abc
AAlAlCl3Al(OH)3
BHNO3NONO2
CSiSiO2H2SiO3
DNH3NO2NO
查看答案和解析>>
科目: 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法中正确的是( )
A.在此反应中硝酸体现强氧化性,全部被还原
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com