
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是( )
A.Y、Z、R 3种元素组成的化合物水溶液一定显碱性
B.原子半径:Z>R>W
C.气态氢化物稳定性:HW>H2R
D.XW4分子中各原子均满足8电子结构
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
正长石的主要成分为硅酸盐,由前20号元素中的4种组成,化学式为XYZ3W8。其中,只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等。Y3+与W的阴离子具有相同的电子层结构。X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是( )
A.X的离子半径>Y的离子半径
B.Z的氢化物的稳定性<W的氢化物的稳定性
C.Y的氧化物既能与盐酸反应,又能与NaOH溶液反应
D.X2W2、Y2W3两种化合物含有的化学键类型完全相同
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是( )

A.5种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
甲、乙、丙、丁是原子序数依次增大的4种短周期元素,A、B、C、D、E是由其中的2种或3种元素组成的化合物,F是由丙元素形成的单质。已知:A+B=D+F,A+C=E+F; 0.1 mol·L-1D溶液的pH为13(25 ℃)。下列说法正确的是( )
A.原子半径:丁>丙>乙>甲
B.乙元素在周期表中的位置为第三周期第ⅣA族
C.1 mol A与足量B完全反应共转移了1 mol电子
D.1.0 L 0.1 mol·L-1E溶液中阴离子总的物质的量小于0.1 mol
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
下表是元素周期表的一部分,有关说法正确的是( )
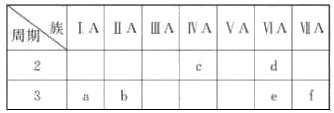
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.6种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
R、X、Y、M、Z 5种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同。下列叙述正确的是( )
A.Z与M形成的化合物中不可能含有非极性键
B.对应氢化物的热稳定性:X > Y >M
C.单质的还原性:R> M>Y>X
D.X、Y、M、Z 4种元素组成的离子化合物受热易分解
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是( )
A.W、M的某种单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,W的氢化物水溶液酸性比Z弱
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
元素性质元素编号
ABCDEFGH
原子半径(nm)0.1020.1100.1170.0740.0750.0710.0990.077
最高化合价+6+5+4+5+7+4
最低化合价-2-3-4-2-3-1-1-4
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2 是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是________________;
(2)C和H的气态氢化物的稳定性强弱关系为______________(用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_____________________________________。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3===2________+CO2
横线上某盐的化学式应为________。
(5)在一密闭容器中发生反应2AD2+D2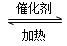 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。在下列方框内绘出该实验方案装置图。

查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F元素是原子序数依次增大的6种短周期元素。已知A是短周期元素中原子半径最小的元素,A和B形成的18电子的化合物X常用作火箭的燃料,C原子最外层电子数与核外电子总数之比为3∶4,E与C同主族,D和C可以形成原子个数比为1∶1和2∶1的两种离子化合物。
据此回答下列问题:
(1)D和C形成1∶1的化合物中阴阳离个数比为____________。
(2)化合物X的结构式为____________。1 mol气态X在适量C2中燃烧,生成B2和气态A2C, 放出534 kJ的热量,1 mol液态A2C完全汽化需吸收44 kJ热量。请写出气态X在C2中燃烧生成B2和液态A2C时的热化学方程式_____________________________________
(3)某化合物由上述6种元素中的3种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为__________________;该化合物水溶液不呈中性的原因是(用离子方程式表示)__________________________________,该化合物可以通过电解D和F形成化合物的水溶液获得,电解时反应的化学方程式为_________________________________
(4)写出一个可以证明C的非金属性大于E的化学反应方程式:_____________________________________________。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
在常温下,X2(g)和H2反应生成HX的平衡常数如表中所示,仅依据K的变化,关于等物质的量浓度的H2与X2的反应,下列说法正确的是( )
化学方程式 | 平衡常数K |
F2+H2 | 6.5×1095 |
Cl2+H2 | 2.6×1033 |
Br2+H2 | 1.9×1019 |
I2+H2 | 8.7×102 |
A.F2的转化率最大
B.X2与H2反应的剧烈程度逐渐减弱
C.X2与H2反应的反应速率依次减小
D.升高温度,平衡常数都增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com