
科目: 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷B(解析版) 题型:实验题
如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选择,必要时可重复选用。
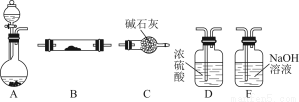
请回答下列问题:
(1)在装置A的圆底烧瓶中装入锌片,分液漏斗中装入稀硫酸,以验证H2的还原性并检验其氧化产物。
①若按顺序A→D→B→B→C连接时,则两次使用的装置B中所盛放药品的化学式依次为CuO、 (填化学式)。
②检验装置的气密性后,在加热装有CuO的装置B前必须进行的操作是 。
(2)在装置A的锥形瓶中装入Na2O2,分液漏斗中装入浓氨水,装置B中装入固体催化剂,以进行氨的催化氧化。
①若装置的连接顺序为A→C→B→C,则装置B中氨的催化氧化反应的化学方程式为 ,装置B中可能观察到的现象是 。
②若把装置A制得的气体与Cl2混合在一起,产生白烟,写出反应的化学方程式 。该反应体现了氨的 性。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷B(解析版) 题型:实验题
某化学小组用下列装置对铁及其化合物的性质进行探究,回答有关问题:
(1)该小组同学想制得氢氧化亚铁并保存较长时间,按如图(a)所示装置对其进行操作。
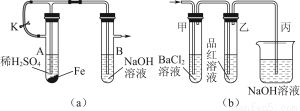
①某同学的操作是:先夹紧止水夹K,再使A管开始反应,实验中在B管中观察到的现象是
。
②为达到实验目的,正确的操作是 。
B管中发生反应的离子方程式是 。
(2)当上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后得到FeSO4,再高温煅烧(有关装置和操作均已略去),最后留下红棕色固体,将分解时产生的气体按图(b)所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因
。
②为验证红棕色固体成分,可进行如下操作
。
③图(b)中丙装置的作用是 。
④根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生反应的化学方程式 。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:选择题
下列化学工业有关设备、原料、反应条件配套的是 ( )
A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30 ℃~35 ℃的氨化饱和食盐水吸收CO2
B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000~5000 ℃
C.合成氨:沸腾炉、焦炭、铁触媒、500 ℃
D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000 ℃
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:选择题
海水淡化的方法有多种,如蒸馏法、电渗析法等。电渗析法是一种利用离子交换膜进行离子交换的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为惰性电极。下列叙述中正确的是( )
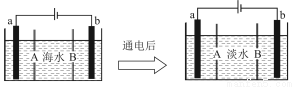
A.B膜是阴离子交换膜
B.通电后,海水中阳离子向a电极处运动
C.通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2↑
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
请回答下列化工生产中的一些问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号)。
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2(g)+O2(g) 2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃ | 600 | 620 | 640 |
炉渣中CuSO4的质量数/% | 9.3 | 9.2 | 9.0 |
已知CuSO4 在低于660 ℃时不会分解,请简要分析上表中CuSO4 的质量分数随温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式 。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
银氨溶液放久后会产生叠氮化银(AgN3)而引起爆炸,直接排放会污染环境,且造成银资源的浪费。某研究小组设计了从银镜反应后的废液中(含过量的银氨溶液,假设不含单质银)回收银的如下两种实验流程:
(已知:[Ag(NH3)2]+在溶液中存在平衡:[Ag(NH3)2]+??Ag++2NH3)
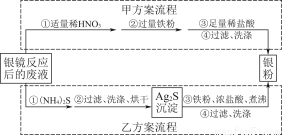
(1)写出甲方案第①步废液与稀HNO3反应的离子方程式 。
(2)甲方案第②步加入的铁粉要过量的目的是 。
甲方案流程可能产生的大气污染物是 。
(3)乙方案若最终得到银粉的质量偏大,排除未洗涤干净的因素,可能的原因是 。
(4)实验室配制银氨溶液的操作过程是 。
(5)已知乙方案第③步反应有H2S气体产生,若最终得到银粉21.6 g,不考虑其他损失,理论上该步需要加入铁粉 g。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:
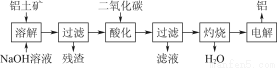
(1)电解生成的铝在熔融液的 (填“上层”或“下层”),电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式
。
(3)电解制备铝时,需加入冰晶石(Na3AlF6),其作用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式 。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是 (填化学式),阳极的电极反应式为 。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见图),此时铝表面可形成耐酸的致密氧化膜,其电极反应式为 ;
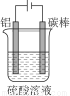
②钢材镀铝后,能防止钢材腐蚀,其原因是 。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。
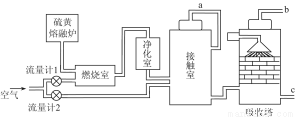
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),该尾气的处理方法是 _。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废气减少
D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面 (可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
据科学家预测:再过100年后,全球气温估计将上升大约1.4~5.8 ℃。根据这一预测,全球气温上升将给全球环境带来不可估测的影响,其中水资源的匮乏将是首当其冲。海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既能解决淡水资源缺乏的问题,又能充分利用海洋资源。
(1)就目前技术而言,结合能源消耗等问题,下列适用于“海水淡化”的技术是 (填序号)。
A.蒸馏法;B.电渗析法;C.冷结法;D.离子交换法;E.反渗透法
(2)远古时代就利用海水晒盐,此项技术属于物质分离实验操作中的 。
(3)海水晒盐得到的母液中,还有大量的镁、钾离子和一定量的溴、碘化合物。其中通过先进的分离技术得到MgCl2·6H2O产品,此产品还需要在不断通入“干燥氯化氢”的条件下脱水才能得到无水MgCl2,原因是 ;
如果实验以海水、氯气等为基本原料来制得单质溴、碘,最基本的操作过程是 、 、 。
(4)钛被称为21世纪金属,具有密度小、强度大,不溶于一般的强酸、强碱等优良性能,广泛用于航空、航天以及生物医学等领域。工业上可以用Mg高温还原TiCl4而制得。请设计合理的实验操作,处理上述反应产物,得到纯钛,简述操作过程: 。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:选择题
下列有关元素锗及其化合物的叙述中正确的是( )
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是四面体构型
C.二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳的单质都是原子晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com